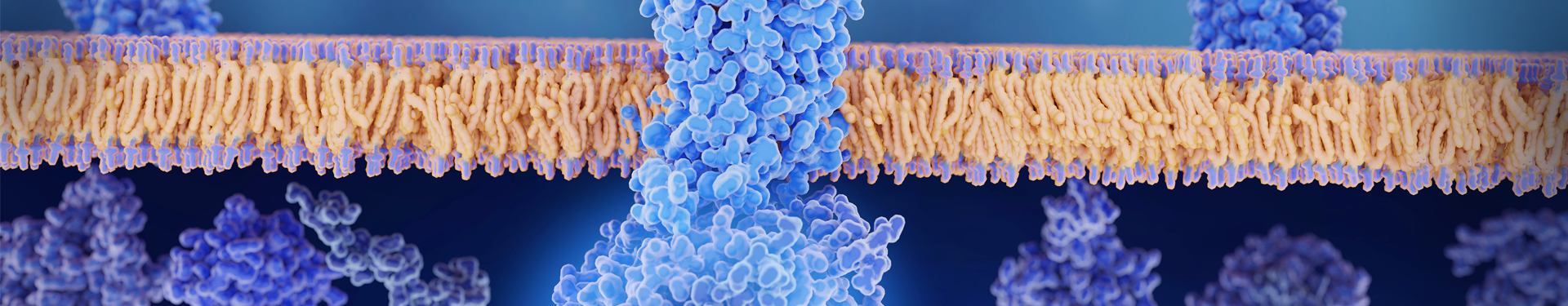
|
Anwendungs-
|
Enzyme
|
Funktion
|
|
Enzyme für die lineare RNA-Produktion, RNase-frei
|
Restriktionsendonukleasen
|
Linearisierung der Plasmid-DNA (pDNA), um die Entstehung längerer Transkripte zu vermeiden.
|
|
T7-RNA-Polymerase (T7-RNAP)
|
Binden Sie an den T7-Promotor und erzeugen Sie ein spezifisches RNA-Transkript. Spielen eine Schlüsselrolle bei der In-vitro-Transkript-Reaktion (IVT).
|
|
Vaccinia-Capping-Enzym
|
Fügen Sie Cap-Strukturen an den 5′-Enden der IVT-mRNA hinzu.
|
|
Pyrophosphatase, anorganisch (iPPase)
|
Vermeiden Sie Pyrophosphat während der IVT-Reaktion.
|
|
RNase-Inhibitor, rekombinant
|
Hemmt die RNase-Aktivität während der IVT-Reaktion.
|
|
DNase I
|
Entfernen Sie die DNA-Vorlage.
|
|
Enzym zur circRNA-Produktion, RNase-frei
|
RNase R
|
Verdauen Sie lineare RNA und reichern Sie zirkuläre RNA an.
|
|
Enzymvermittelte Glykankonjugation
|
Peptid-N-Glycosidase (PNGase F)
|
Spaltt die Amidbindung zwischen dem ersten Saccharid GlcNAc und der Asn297-SeitenketteL; Setzen Sie Glykane aus IgG-Antikörpern frei.
|
|
Bakterielle Transglutaminase (BTG)
|
Konjugieren Sie Payloads standortspezifisch, um ADCs zu generieren.
|
|
Sortase A
|
Katalysieren Sie die Ligation von Proteinen.
|
|
β1,4-Galactosidase
|
Geben Sie alle terminalen Galaktosen frei und bilden Sie eine homogene G0-Isoform des Antikörpers.
|
|
β1,4-Galactosyltransferase (Gal-T)
|
Übertragen Sie einen Zuckerrest mit einer chemisch reaktiven funktionellen Gruppe.
|
|
α2,6-Sialyltransferase (Sial T)
|
Integrieren Sie terminale Sialinsäurereste in die native Glykanstruktur eines Antikörpers.
|
|
Enzymvermittelter Glykan-Remodelling und Glycoengineering
|
Endo-N-Acetylglucosaminidase (ENGase)
|
Hydrolysieren Sie die β1,4-glykosidische Bindung zwischen GlcNAcβ1–4GlcNAc von N-Glykanen; Entfernen Sie N-gebundene Glykane in der Fc-Region von IgG-Antikörpern.
|
|
Endoglykosidase S (EndoS)
|
|
|
Glykosyltransferasen (GTs)
|
Übertragen Sie N-Glykanoxazolin auf defucosylierte IgGs.
|
|
Andere
|
Von mikrobiellen Stämmen produzierte Enzyme
|
Maßgeschneiderter Bedarf
|

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NEIN
NEIN
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN