Die Bedeutung der Formulationsentwicklung
Biologische Arzneimittel, wie rekombinante Proteine oder Peptide, sind weniger stabil als Kleinmolekülarzene. Wenn ein Medikament nicht in einer stabilen Form verabreicht werden kann, wird es möglicherweise nicht einmal jenseits der ersten Studien bei Menschen (FIH) gehen.
Daher ist die Formulationsentwicklung eines der wichtigsten Aspekte im biologischen Lebenszyklus, um Qualität, Effizienz und Stabilität des Medikaments während der Herstellung, des Transports, der langfristigen Lagerung und der Verabreichung sicherzustellen.
Schlüsselwörter: Formulationsentwicklung und -optimierung für Biopharmazeutika, Dosierungsform von Biologika, Zusammensetzung der Medikamentenformulierung, Prä-Formulationsstudien, Formulationsforschung, Formulationsscreening
Anwendung: Biopharmazeutische Industrie, Humane Medizin, Veterinärmedizin, Impfstoffe, rekombinante Makromoleküle, Biologika, biologisches Reagenz
Formulationsentwicklungs-Dienstleistungen von Yaohai Bio-Pharma
Flüssige und lyophilierte (trockengefrorene) Formulierungen stellen derzeit die gebräuchlichsten Verabreichungsw Wege für Biologika dar.
Yaohai Bio-Pharma spezialisiert sich auf die Entwicklung von flüssigen Wirkstoffen (DS) oder Arzneimitteln (DP) sowie lyophilierten DP in Ampullen oder Fertigspritzen für verschiedene Verabreichungswege, einschließlich intravenös (IV), subkutan (SC), intravitreal (IVT) und Inhalation (INH).
Wir wenden One-Time-A-Factor (OTAF) oder Design-of-experiments (DoE) zur phaseangemessenen Formulationsentwicklung und -optimierung an, einschließlich der folgenden Schritte:
- Vorformulierungsuntersuchungen der physikalisch-chemischen Eigenschaften und Stabilität von Proteinen
- Formulierungsscreening und -optimierung von flüssigen Wirkstoffen (DS)
- Formulierungsscreening und -optimierung von flüssigen Endprodukten (DP)
- Formulierungsscreening und -optimierung von lyophilierten Endprodukten (DP)
- Entwicklung des Füllprozesses und des Lyophilisierungskreislaufs
- Standard-Echtzeit- und beschleunigte Stabilitätstests sowie Akut-Stress-Studien
Service Details
| Service Details |
Einzeloperationen |
Unser Fokus |
| Präformulationsprüfung |
Physikalisch-chemische Eigenschaften Stabilitätstests |
Entscheiden Sie sich für eine geeignete Formulierung (z. B. Flüssigkeit, lyophilisiert) für frühe oder späte klinische Studien |
| Flüssige DS- oder DP-Formulierung |
High-throughput flüssige Formulierungsscreening |
Pufferzusammensetzungen, pH, Ionenstärke, Stabilisatoren, Tenside, Hilfsstoffe, Adjuvanzien usw. |
| Lyophilisierte DP-Formulierung |
High-throughput lyophilisierte Formulierungsscreening |
Lyoprotektant (z. B. Saccharose, Trehalose), Puffersystem, Hilfsstoffe usw. |
| Prozessentwicklung für flüssiges DP |
Adjuvanzubereitung und Sterilisierungstechnik – optional |
Stabilitätsstudien der Adjuvantformulierung |
| DS-Verdünnung und DP-Zubereitung |
Dosedstärke, Pumpstudie, Rührgeschwindigkeit, Scherkräfte |
| Füllen und Verpacken |
Füllmenge, Mischstudie, Scherkräfte |
| Lyophilisierungsprozessentwicklung |
Entwicklung des Lyophilisierungskreises |
Qualität des lyophilisierten DP |
| Qualitätsprüfung |
Reinheit, Integrität, Löslichkeit, Viskosität, Aktivität und Aggregation usw. |
Der Einfluss von Formulationszusammensetzungen und -verfahren auf die DS/DP-Qualität |
| Stabilitätstudien |
Fallstudie
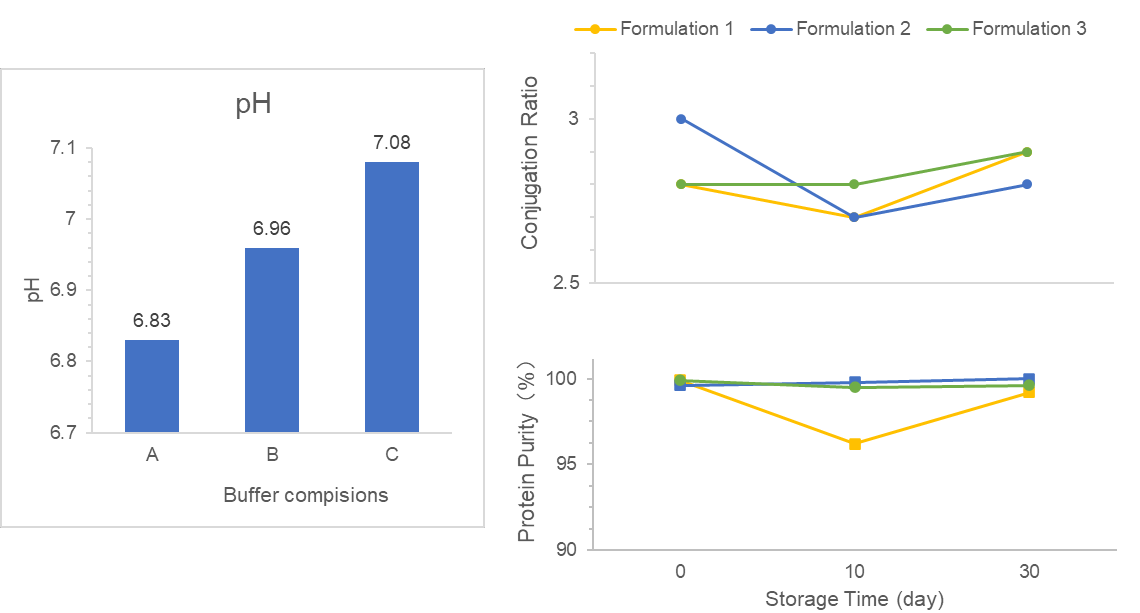
Wir wurden beauftragt, eine DS/DP-Formulierung für ein VLP-Konjugatimpfstoff zu testen und einen DS/DP-Prozess zu entwerfen.
Zunächst筛选ten wir geeignete Puffer in der DS-Formulierung aus, um die gewünschte Stabilität, Bioverfügbarkeit und klinische Sicherheitsanforderungen zu erfüllen. Anschließend optimierten wir mehrere Faktoren in der adjuvantbasierten DP-Formulierung, um die Antigenadsorptionspegel zu verbessern. Darüber hinaus konzentrierten wir uns auf die DS/DP-Qualität und entwickelten einen stabilen Produktionsprozess.

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NO
NO
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN


