Die Bedeutung der Formulierungsentwicklung
Biologische Arzneimittel wie rekombinante Proteine oder Peptide sind weniger stabil als niedermolekulare Arzneimittel. Wenn ein Medikament nicht in stabiler Form verabreicht werden kann, kommt es möglicherweise nicht einmal über FIH-Studien (First-in-Human) hinaus.
Daher ist die Formulierungsentwicklung einer der kritischsten Aspekte im biologischen Lebenszyklus, um die Qualität, Effizienz und Stabilität von Arzneimitteln während der Herstellung, dem Transport, der Langzeitlagerung und der Verabreichung sicherzustellen.
Schlüsselwörter: Entwicklung und Optimierung biopharmazeutischer Formulierungen, Darreichungsform von Biologika, Zusammensetzung der Arzneimittelformulierung, Studien vor der Formulierung, Formulierungsforschung, Formulierungsscreening
Anwendung: Biopharmazeutische Industrie, Humanmedizin, Tiermedizin, Impfstoffe, rekombinante großmolekulare Biologika, Biologika, biologische Reagenzien
Formulierungsentwicklungsdienste von Yaohai Bio-Pharma
Flüssige und gefriergetrocknete Formulierungen stellen derzeit die gängigsten Verabreichungsarten für Biologika dar.
Yaohai Bio-Pharma ist auf die Entwicklung flüssiger Arzneimittelsubstanzen (DS) oder Arzneimittelprodukte (DP) sowie gefriergetrockneter DP in Fläschchen oder vorgefüllten Spritzen für verschiedene Verabreichungswege spezialisiert, darunter intravenös (IV), subkutan (SC), intravitreal (IVT) und Inhalation (INH).
Wir wenden One-Time-A-Factor (OTAF) oder Design-of-Experimente (DoE) zur phasengerechten Formulierungsentwicklung und -optimierung an, einschließlich der folgenden Schritte:
- Prüfung der physikalisch-chemischen Eigenschaften und Stabilität von Proteinen vor der Formulierung
- Screening und Optimierung der Formulierung flüssiger Arzneimittelsubstanzen (DS).
- Screening und Optimierung der Formulierung flüssiger Arzneimittel (DP).
- Screening und Optimierung der Formulierung lyophilisierter Arzneimittel (DP).
- Entwicklung des Fill-Finish-Prozesses und des Gefriertrocknungszyklus
- Standardmäßige Echtzeit- und beschleunigte Stabilitätsstudien sowie Studien zu akutem Stress
Service Details
| Service Details |
Einheitsbetrieb |
Über Uns |
| Tests vor der Formulierung |
Physikalisch-chemische Eigenschaften Stabilitätsprüfung |
Entscheiden Sie sich für eine geeignete Formulierung (z. B. flüssig, lyophilisiert) für frühe oder späte klinische Studien |
| Flüssige DS- oder DP-Formulierung |
Hochdurchsatz-Screening flüssiger Formulierungen |
Pufferzusammensetzungen, pH-Wert, Ionenstärke, Stabilisatoren, Tenside, Hilfsstoffe, Adjuvantien usw. |
| Lyophilisierte DP-Formulierung |
Hochdurchsatz-Screening lyophilisierter Formulierungen |
Lyoprotektivum (z. B. Saccharose, Trehalose), Puffersystem, Hilfsstoffe usw. |
| Prozessentwicklung für flüssige DP |
Adjuvansvorbereitung und Sterilisationstechnik – optional |
Stabilitätsstudien der Adjuvansformulierung |
| DS-Verdünnung und DP-Vorbereitung |
Dosisstärke, Pumpstudie, Rührgeschwindigkeit, Scherkräfte |
| Füllen und fertig |
Füllvolumen, Mischstudie, Scherkräfte |
| Entwicklung des Gefriertrocknungsprozesses |
Entwicklung des Gefriertrocknungszyklus |
Lyophilisierte DP-Qualität |
| Qualitätsprüfung |
Reinheit, Integrität, Löslichkeit, Viskosität, Aktivität und Aggregation usw. |
Die Auswirkung von Formulierungszusammensetzungen und -prozessen auf die DS/DP-Qualität |
| Stabilitätsstudien |
Case Study
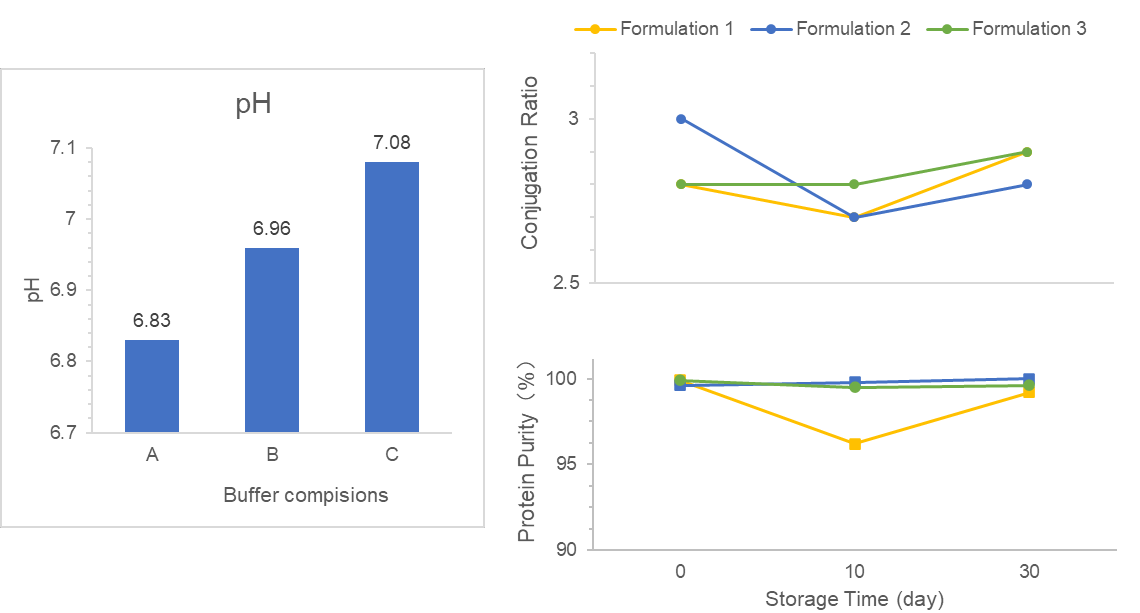
Wir werden damit beauftragt, die DS/DP-Formulierung zu prüfen und den DS/DP-Prozess für einen VLP-Konjugatimpfstoff zu entwerfen.
Zunächst haben wir geeignete Puffer in der DS-Formulierung gescreent, um die gewünschten Stabilitäts-, Bioverfügbarkeits- und klinischen Sicherheitsanforderungen zu erfüllen. Zweitens haben wir mehrere Faktoren in der Adjuvans-basierten DP-Formulierung optimiert, um die Antigenadsorptionsniveaus zu verbessern. Darüber hinaus haben wir uns auf die DS/DP-Qualität konzentriert und einen stabilen Herstellungsprozess entwickelt.

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NEIN
NEIN
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN


