Rekombinante Plasmide sind ein wichtiges Vektorfeld im Bereich der Zell- und Gentranskription (CGT), das als verwendet werden kann,
-
DNA Therapeutikum (Unbeschütztes Plasmid-DNA für Therapie) - Unbeschütztes Plasmid als Genexpressionvektor, als Alternative zur Eiweiß/Enzym-Ersatztherapie.
-
DNA Impfstoffe für prophylaktische und therapeutische Verwendung - Plasmid als Genvektor, der Antigene von Viren, Bakterien oder Krebszellen exprimiert.
- Ausgangsmaterialien für die Produktion von Virenvektoren - Rekombinante Plasmide können zur Herstellung von Lentivirus (LV) und Adeno-assoziiertem Virus (AAV) für Virenvektormimpfstoffe, Gentranskription oder Genediting verwendet werden.
- Ausgangsmaterialien für die Produktion von mRNA/circRNA - Linearisierte Plasmide, als Vorlagen für die in vitro Transkription, sind Schlüsselmaterialien für mRNA/circRNA-Impfstoffe oder -Medikamente.
1 Unbeschütztes Plasmid-DNA
1.1 Unbeschütztes Plasmid-DNA für den menschlichen Gebrauch
Die derzeit auf dem Markt erhältlichen Gentranskurzmittel nutzen hauptsächlich virale Vektoren wie AAV und LLV. Forschungsberichte haben jedoch gezeigt, dass eine durch virale oder zelluläre Vektoren vermittelte Gentranskurztherapie mit angiogenen Faktoren zu der Bildung von Gefäßtumoren in der Mausherz führen kann. Um eine übermäßige Expression von angiogenen Faktoren zu vermeiden, wird die Verwendung von freien Plasmiden mit Plasmid-DNA als Gentransfervektor bevorzugt, da diese eine geringere Expression des Zielproteins im Lebewesen erzeugen.
Daher liegt der Hauptentwicklungsfookus bei der Therapie mit freien Plasmiden auf der Gentranskurztherapie mit angiogenen Faktoren. Bislang gibt es weltweit zwei zugelassene freie Plasmidmedikamente für den menschlichen Gebrauch: Neovasculgen, das 2011 in Russland eingeführt wurde, und Collategene, das 2019 auf den japanischen Markt kam. Mehrere andere freie Plasmidmedikamente befinden sich derzeit in den klinischen Phasen II-III. Kodierende Gene umfassen HGF, VEGF-A, SDF-1 (CXCL12) und andere.
1.2 Freie Plasmid-DNA für tierischen Gebrauch
Im Gegensatz zu Medikamenten für den Menschen haben DNA-Impfstoffe beim Tiergebrauch, einschließlich veterinärer und Haustieranwendungen, mehr Erfolg gehabt.
Tabelle 1. Zertifizierte DNA-Therapeutika für den menschlichen und tierischen Gebrauch
|
Anwendung
|
Produkt
|
Art
|
Ziel
|
Angabe
|
Unternehmen
|
Zertifizierungsdatum/ Land
|
|
Gen-Therapie
|
Neovasculgen, Cambiogenplasmid, PI-VEGF165
|
Mensch
|
VEGF-A
|
CLI, kritische Gliedmaßenischemie
|
Human Stem Cell Institute
|
2011/ Russland
|
|
Gen-Therapie
|
Collategene, beperminogene perplasmid, AMG0001
|
Mensch
|
HGF
|
CLI, kritische Gliedmaßenischemie
|
AnGes
|
2019/Japan
|
|
Gen-Therapie
|
LifeTideSW5
|
Schweine
|
Porcines Wachstumshormonfreisetzungshormon (GHRH)
|
Erhöhe die Anzahl der entwöhnten Ferkel.
|
VGX Animal Health
|
2008/Australien
|
|
Krebsimmuntherapie
|
Oncept
|
Hunde
|
Tyrosinase
|
Orales malignes Melanom (OMM)
|
Merial, Boehringer Ingelheim Animal Health
|
2010/USA
|
|
Antimikrobielle
|
Zelnate
|
Rind
|
Aktualisierung ausstehend
|
Bovine respiratorische Erkrankung (BRD) durch Mannheimia haemolytica
|
Diamond Animal Health, Bayer
|
2013/USA
|
2 DNA-Impfstoff
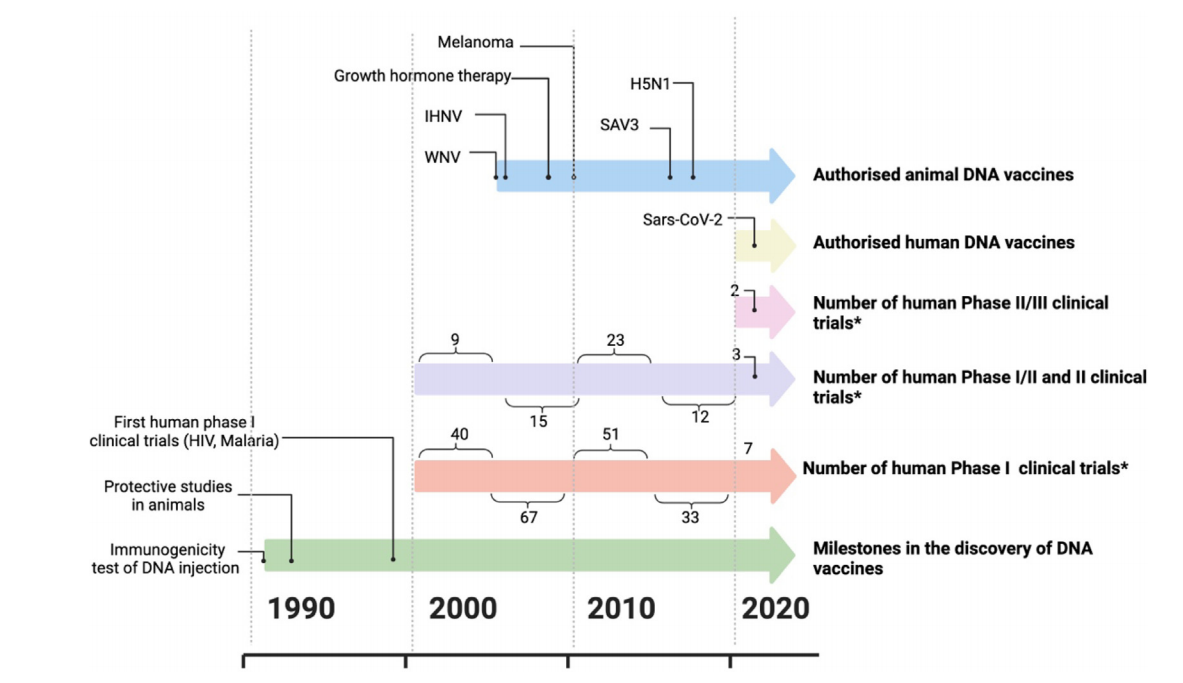
Abb. 1. Entwicklung von DNA-Impfstoffen
2.1 DNA-Impfstoff für den menschlichen Gebrauch
Die geringe Immunogenität bei Menschen stellt weiterhin eine große Herausforderung für die Anwendung von DNA-Impfstoffen dar, trotz der Fortschritte in tierischen Modellen.
Darüber hinaus hat die Erforschung von DNA-Impfstoffen für Infektionskrankheiten wie HIV, Tuberkulose und Malaria die Entwicklung vielfältiger Optimierungsstrategien in den folgenden Jahren gefördert.
Tabelle 2. Genehmigte DNA-Impfstoffe für den menschlichen Gebrauch
|
Verwendungen
|
Marke
|
Ziel/Bewilligung
|
Bühne
|
Unternehmen
|
|
Prophylaktischer Impfstoff
|
ZyCoV-D
|
Spike-Protein; SARS-CoV-2
|
Notfallgenehmigung in Indien
|
Zydus Cadila
|
2.2 DNA-Impfstoff für tierischen Gebrauch
DNA-Impfstoffe in der Tiermedizin haben große Fortschritte gemacht, da verschiedene Produkte Lizenzierungen für Infektionskrankheiten erhalten haben, wie z. B. Krebsimmuntherapien und Gendtherapieanwendungen.
Tabelle 3. Genehmigte DNA-Impfstoffe für den tierischen Gebrauch
|
Verwendungen
|
Marke
|
Art
|
Ziel/Bewilligung
|
Unternehmen
|
Zertifizierungsdatum/ Land
|
|
Prophylaktischer Impfstoff
|
West Nile-Innovator
|
Pferde
|
West Nile Virus (WNV)
|
USA CDC, Fort Dodge Animal Health
|
2005/USA
|
|
Apex-IHN
|
Lachs
|
Infektiöse hämatopoetische Nekrosevirus (IHNV)
|
Novartis Animal Health
|
2005/Kanada
|
|
Clynav
|
Lachs
|
Salmon alphavirus Untertyp 3 (SAV3)
|
Elanco Animal Health
|
2016/EU
|
|
ExactVac
|
Geflügel
|
Avian Influenza A (H5N1)
|
AgriLabs
|
2017/USA
|
3 Plasmid-DNA als Materialien für die Produktion von mRNA oder Virenvektoren
mRNA und kreisförmige mRNA (circRNA) werden seit langem in der Impfstoffentwicklungsforschung eingesetzt. Linearisiertes Plasmid-DNA dient als notwendiges Transkriptionstemplate für IVT-mRNA, das durch die T7-RNA-Polymerase ermöglicht wird.
Der Virenvektor hebt sich als die effizienteste Methode für den Gentransfer hervor, wodurch eine gezielte Modifizierung spezifischer Zelltypen oder Gewebe ermöglicht wird und eine Manipulation zur Expression therapeutischer Gene zulässt. Bei der Herstellung von Virenvektoren spielt Plasmid-DNA eine entscheidende Rolle.
Yaohai Bio-Pharma bietet eine umfassende CDMO-Lösung für Plasmid-DNA
Quelle:
[1] Pagliari S, Dema B, Sanchez-Martinez A, Montalvo Zurbia-Flores G, Rollier CS. DNA-Impfstoffe: Geschichte, molekulare Mechanismen und zukünftige Perspektiven. J Mol Biol. 2023 Dez 1;435(23):168297. doi: 10.1016/j.jmb.2023.168297.

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NO
NO
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN


