DNA-Impfstoffe und mRNA-Impfstoffe haben Ähnlichkeiten, da beide beliebige Antigene, die mit pfadogenetischen Mikroorganismen oder Tumoren in Zusammenhang stehen, kodieren können und die Immunantwort ohne Virenvektoren oder Adjuvanzien anregen können. Was jedoch die Struktur betrifft, sind DNA-Impfstoffe stabiler als mRNA-Impfstoffe. Neben ihrer Verwendung in der Infektionskrankheitsprävention haben DNA-Impfstoffe auch reiche klinische Erfahrungen im Bereich der Tumortherapie gesammelt. DNA-Impfstoffe haben eine bedeutende Marktanwendung sowohl im Bereich der menschlichen als auch der tiermedizinischen Impfstoffe.
Yaohai Bio-Pharma, mit seiner leistungsstarken Prozessentwicklungsplattform und umfangreichen Erfahrungen in der Plasmid-DNA-Produktion, kann Kunden eine umfassende Lösung von der Plasmid-DNA-Stammzellentwicklung bis zur GMP-Produktion anbieten. Wir passen den Serviceprozess flexibel den individuellen Anforderungen der Kunden an und bieten hochwertige DNA-Wirkstoffe (DS) oder Medikamente (DP) in Mengen von zehn Gramm bis zu Hunderten von Gramm sowie vollständige Entwicklungs- und GMP-Produktionsdokumente und Testberichte.
Umfassende Plasmid-DNA-Lösung von Yaohai Bio-Pharma
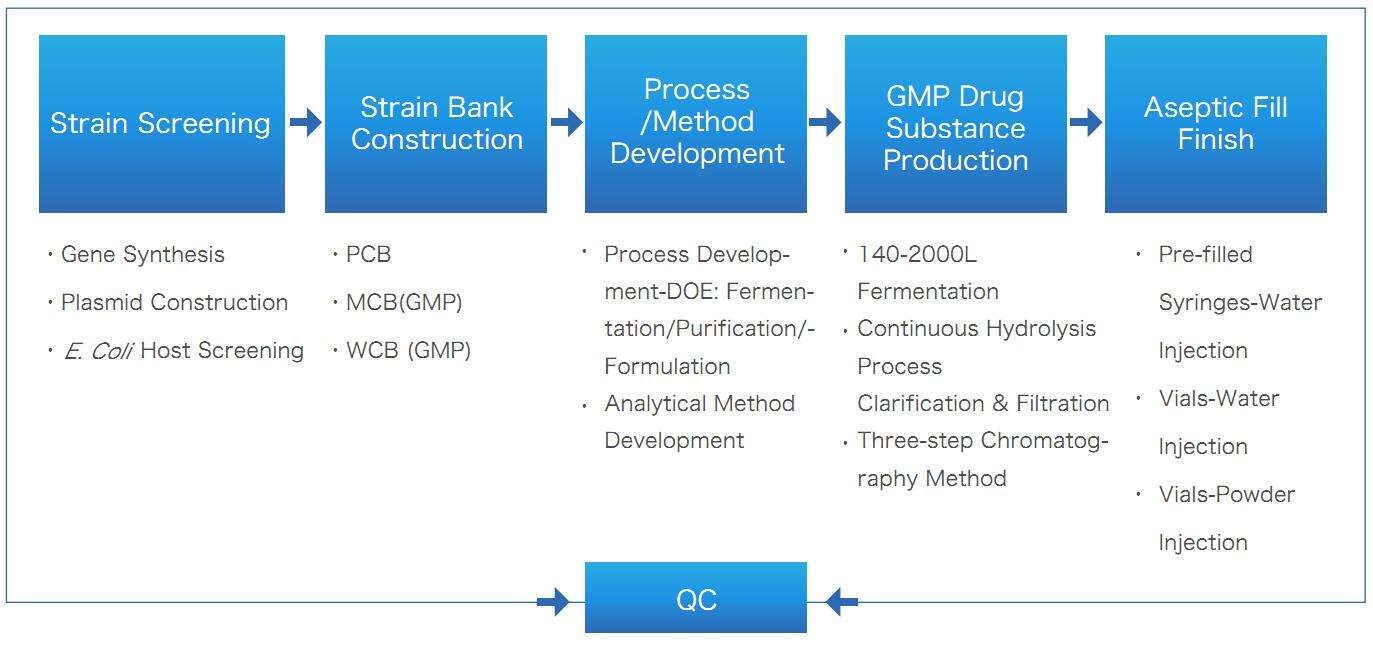
Liefergegenstände
| Qualitätsstufe |
Liefergegenstände |
Spezifikation |
ANWENDUNGEN |
| nicht-GMP |
Wirkstoff |
0,2~10 g (Plasmid-DNA) |
Präklinische Studien,
Entwicklung analytischer Methoden,
Vorstudien zur Stabilität,
Entwicklung der Formulierung
|
| Arzneimittel |
| GMP, Steril |
Wirkstoff |
10~100 g (Plasmid-DNA) |
Investigationsneues Medikament (IND),
Klinische-Prüflizenz (CTA),
Versorgung für klinische Studien,
Lizenzantrag für Biologika (BLA),
Kommerzielle Versorgung
|
| Arzneimittel |
20.000 Vials (flüssig oder lyophilisiert), prägefüllte Spritzen oder Patronen |
Yaohais Plasmid CDMO Dienstleistungen, die den gesamten Lebenszyklus von mRNA abdecken
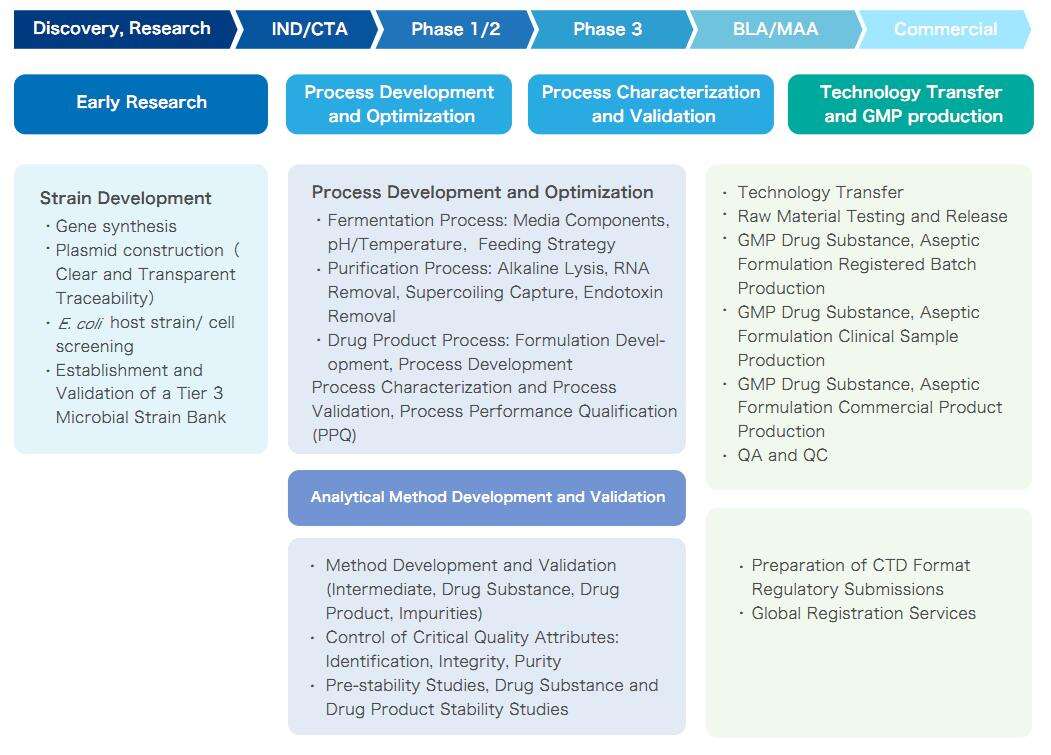
Plattformmerkmale
Plasmid-DNA-Fermentertechnologie
- Mit hoher Dichte Fermentation erreicht die Plasmid-DNA-Ausbeute 1000 mg/L in unserem Plattformprozess
- Keine tierischen Quellen, keine Antibiotika hinzugefügt oder Antibiotika, die den regulatorischen Anforderungen entsprechen
- Basierend auf dem QbD- und DoE-Konzept werden die einflussreichen Faktoren schnell identifiziert, um die Prozessentwicklungziele zu erreichen
- Nach der Bestätigung von 2 bis 3 Chargen wird der Pilotprozess schrittweise skaliert, um das Risiko einer Prozessvergrößerung und -übertragung zu reduzieren.
|
Impfstofftyp
|
Kundenbedarf
|
Yaohais Lösungen
|
|
Therapeutisches DNA-Impfstoff
|
Entwicklung des Fermentationsprozesses: Fokus auf Plasmid-DNA-Produktion
|
Wir entwickelten tierfreie Medien und den Fermentationsprozess der gentechnisch veränderten Bakterien E. coli, und der Fed-Batch-Fermentationsertrag überschreitet 1000 mg/L an Plasmid-DNA.
|
Plasmid-DNA-Reinigungsprozess
- Wir entwickeln Formulierungsstrategien und Produktionsansätze auf Basis der Komplexität des Projekts, um die wesentlichen Qualitätsmerkmale des Produkts zu erfüllen, während wir die Plasmiderholung erhöhen.
- Wir haben einen stabilen und skalierbaren kontinuierlichen Spaltungsprozess sowie einen dreistufigen Chromatographieprozess etabliert, der Supercoiled-Plasmide effizient fängt und RNA, HCP, HCD und Endotoxine eliminiert.
| Impfstofftyp |
Technologische Herausforderungen |
Yaohais Leistungen |
| Prophylaktisches DNA-Impfstoff |
Unter dem ursprünglichen Prozess des Kunden überschritt HCD das Qualitätsstandardmaß, und der Anteil der Plasmid-Superhelix betrug etwa 80 %.
Ziele der Prozessentwicklung:
Residueller HCD 1 %;
Der Anteil der Superhelix-Plasmide 90 %.
|
Wir haben den Reinigungsprozess entsprechend der kritischen Qualitätsattribute optimiert.
Testergebnisse der Plasmidproben:
Der Anteil der Superhelix betrug 95 %;
Das HCD-Residuum betrug 1 %;
Die HCP- und Endotoxinresiduen erfüllten die Qualitätsstandards.
|
Entwicklung analytischer Methoden
- Wir befolgen Richtlinien wie ICH, Chinesisches Arzneibuch (ChP) und United States Pharmacopeia (USP) und entwickeln umfassende Strategien für die Methodenentwicklung, -validierung und -bestätigung auf der Grundlage der Produktanwendung und der Qualitätsmerkmale.
- Unsere Entwicklungsprojekte umfassen unter anderem die Reinheit von ultrasupercoilierten Plasmiden (HPLC/CE-analytische Methode), HCD, HCP, restliches RNA, restliche Antibiotika usw., wobei Aspekte wie Spezifität, Linearität/Bereich, Genauigkeit, Präzision, Robustheit usw. berücksichtigt werden.
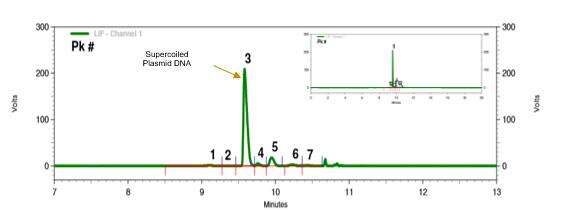
Wir haben ein Analyseprotokoll für Plasmid-DNA basierend auf Kapillar-Gel-Elektrophorese mit laserinduzierter Fluoreszenzerkennung (CGE-LIF) entwickelt. Diese Methode trennt Plasmid-DNA verschiedener Konformationen effektiv mit hoher Auflösung und guter Reproduzierbarkeit.

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NO
NO
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN