DNA-Impfstoffe und mRNA-Impfstoffe haben Ähnlichkeiten darin, dass beide jedes Antigen kodieren können, das mit pathogenen Mikroorganismen oder Tumoren in Zusammenhang steht, und die Immunantwort stimulieren können, ohne dass virale Vektoren oder Adjuvantien erforderlich sind. Allerdings sind DNA-Impfstoffe strukturell stabiler als mRNA-Impfstoffe. Zusätzlich zu ihrem Einsatz zur Prävention von Infektionskrankheiten verfügen DNA-Impfstoffe auch über umfangreiche klinische Erfahrungen im Bereich der Tumortherapie. DNA-Impfstoffe haben sowohl im Human- als auch im Veterinärimpfstoffbereich eine bedeutende Marktanwendung.
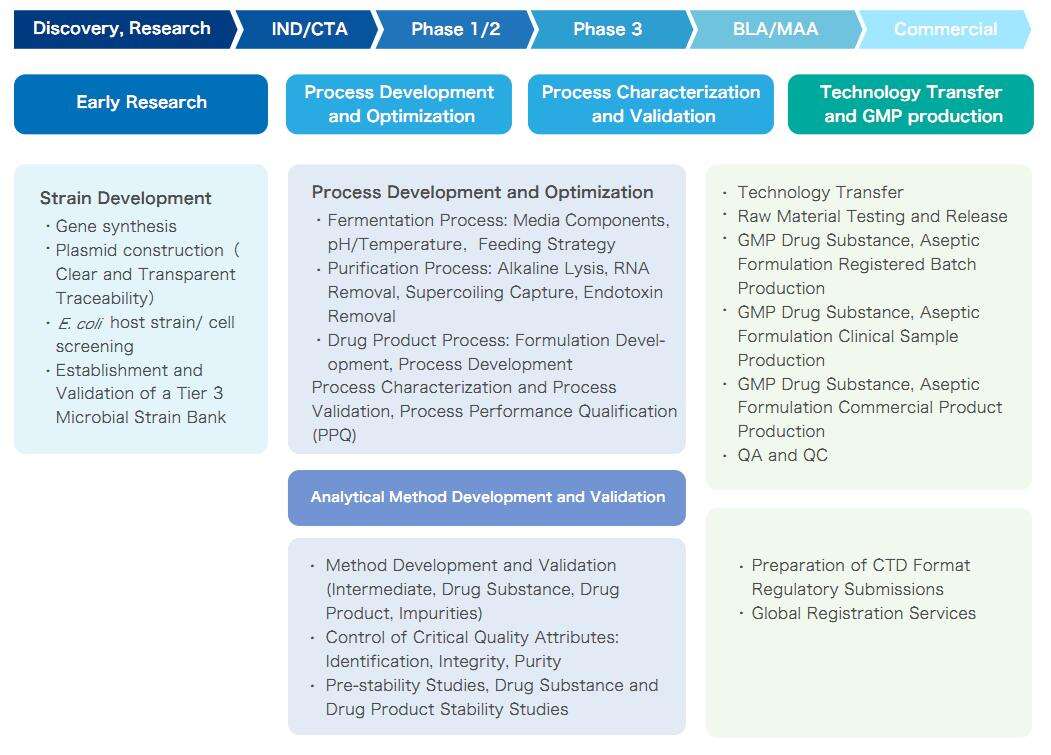
Yaohai Bio-Pharma kann seinen Kunden mit seiner leistungsstarken Prozessentwicklungsplattform und seiner umfangreichen Erfahrung in der Plasmid-DNA-Produktion eine Komplettlösung von der Plasmid-DNA-Stammentwicklung bis zur GMP-Produktion bieten. Wir passen den Serviceprozess flexibel an die individuellen Bedürfnisse der Kunden an und bieten hochwertige DNA-Arzneimittelsubstanzen (DS) oder Arzneimittelprodukte (DP) in Mengen von zehn Gramm bis zu Hunderten von Gramm sowie vollständige Entwicklungs- und GMP-Produktionsaufzeichnungen und Prüfberichte.
One-Stop-Plasmid-DNA-Lösung von Yaohai Bio-Pharma
Leistungen
| Klasse |
Leistungen |
Normen |
Anwendungen |
| Nicht-GMP |
Drogensubstanz |
0.2~10 g (Plasmid-DNA) |
Präklinische Studien,
Entwicklung analytischer Methoden,
Vorstabilitätsstudien,
Formulierungsentwicklung
|
| Arzneimittelprodukt |
| GMP, steril |
Drogensubstanz |
10~100 g (Plasmid-DNA) |
Prüfpräparat (IND),
Genehmigung klinischer Studien (CTA),
Bereitstellung klinischer Studien,
Antrag auf biologische Zulassung (BLA),
Kommerzielle Versorgung
|
| Arzneimittelprodukt |
20,000 Fläschchen (flüssig oder lyophilisiert), Fertigspritzen oder Kartuschen |
Yaohais Plasmid-CDMO-Services decken den gesamten Lebenszyklus von mRNA ab
Platform Funktionen
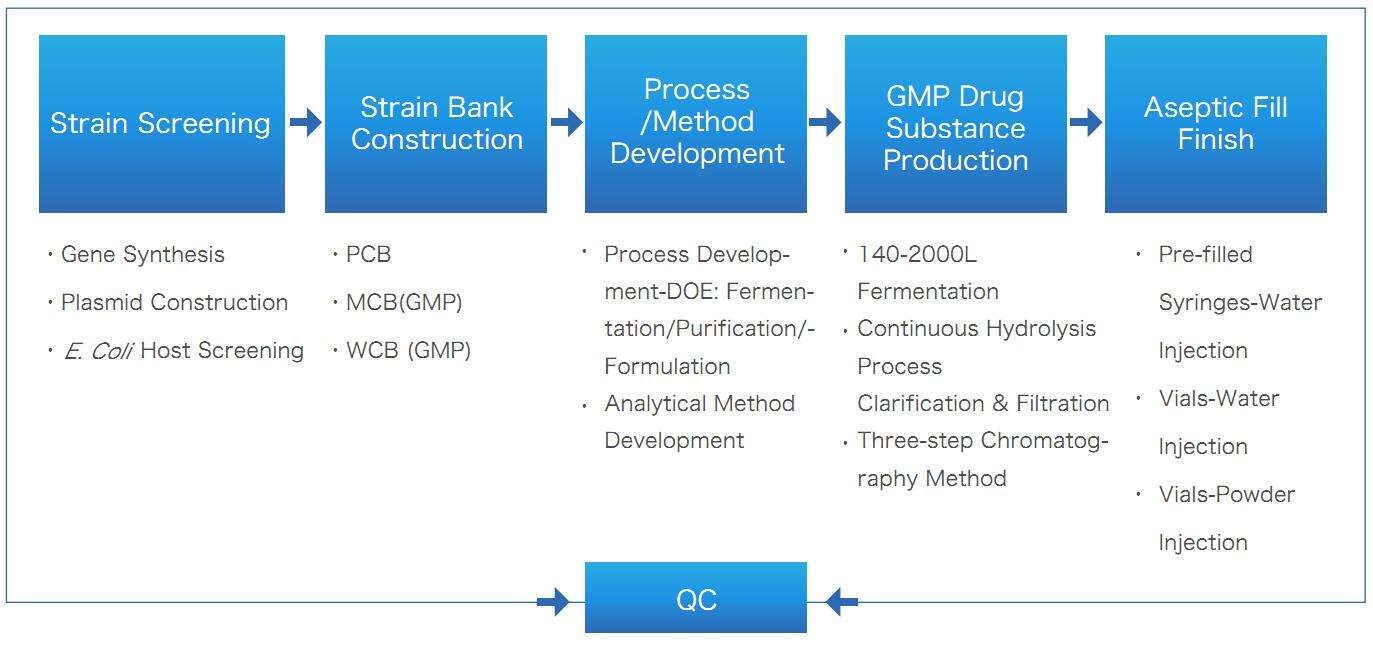
Plasmid-DNA-Fermentationstechnologie
- Bei der Fermentation mit hoher Dichte erreichte die Plasmid-DNA-Ausbeute bei unserem Plattformprozess 1000 mg/L
- Keine tierischen Quellen, keine zugesetzten Antibiotika oder Verwendung von Antibiotika, die den gesetzlichen Anforderungen entsprechen
- Basierend auf dem QbD- und DoE-Konzept können Sie schnell die Einflussfaktoren identifizieren, um die Ziele der Prozessentwicklung zu erreichen
- Nach 2 bis 3 Bestätigungschargen wird der Pilotprozess Schritt für Schritt erweitert, um das Risiko einer Prozessskalierung und Prozessübertragung zu verringern.
|
Impfstofftyp
|
Kundenbedürfnis
|
Yaohais Lösungen
|
|
Therapeutischer DNA-Impfstoff
|
Entwicklung des Fermentationsprozesses: Schwerpunkt auf der Plasmid-DNA-Produktion
|
Wir haben tierfreie Medien und Fermentationsverfahren für die manipulierten Bakterien entwickelt E coli, und die Ausbeute der Fed-Batch-Fermentation übersteigt 1000 mg/L Plasmid-DNA.
|
Plasmid-DNA-Reinigungsprozess
- Wir formulieren Entwicklungs- und Produktionsstrategien basierend auf der Komplexität des Projekts, um die wichtigsten Qualitätsmerkmale des Produkts zu erfüllen und gleichzeitig die Plasmidrückgewinnung zu verbessern.
- Wir haben einen stabilen und skalierbaren kontinuierlichen Spaltungsprozess sowie einen dreistufigen Chromatographieprozess etabliert, der superspiralisierte Plasmide effizient einfangen und RNA, HCP, HCD und Endotoxine eliminieren kann.
| Impfstofftyp |
Technologische Schwierigkeiten |
Yaohais Ergebnisse |
| Prophylaktischer DNA-Impfstoff |
Im ursprünglichen Prozess des Kunden übertraf HCD den Qualitätsstandard und der Anteil an Plasmid-Superhelix betrug etwa 80 %.
Ziele der Prozessentwicklung:
• Rest-HCD < 1 %;
• Der Anteil an Superhelix-Plasmiden > 90 %.
|
Wir haben den Reinigungsprozess entsprechend den kritischen Qualitätsmerkmalen optimiert.
Testergebnisse von Pladmidproben:
• Der Anteil an Superhelix betrug > 95 %;
• Der HCD-Rückstand betrug < 1 %;
• HCP- und Endotoxinrückstände entsprachen den Qualitätsstandards.
|
Analytische Methodenentwicklung
- Wir befolgen Richtlinien wie ICH, Chinese Pharmacopoeia (Chp) und United States Pharmacopeia (USP) und etablieren umfassende Methodenentwicklungs-, Validierungs- und Bestätigungsstrategien basierend auf Produktnutzung und Qualitätsmerkmalen.
- Unsere Entwicklungsprojekte umfassen die Reinheit von Ultra-Supercoiled-Plasmiden (HPLC/CE-Analysemethode), HCD, HCP, Rest-RNA, Restantibiotika usw. mit Überlegungen zu Spezifität, Linearität/Bereich, Genauigkeit, Präzision, Robustheit usw.
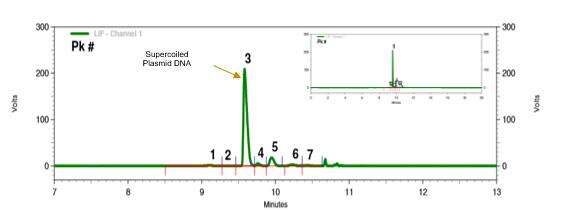
Wir haben ein Plasmid-DNA-Analyseprotokoll entwickelt, das auf Kapillargelelektrophorese mit laserinduzierter Fluoreszenzdetektion (CGE-LIF) basiert. Diese Methode trennt effektiv Plasmid-DNA verschiedener Konformationen mit hoher Auflösung und guter Reproduzierbarkeit.

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NEIN
NEIN
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN