Oltre ai vaccini a sottounità ricombinanti che mirano agli antigeni patogeni, i ricercatori si sono concentrati sugli antigeni legati a proteine nelle cellule tumorali o in altri ant igeni correlati a vie metaboliche. Questi antigeni possono stimolare il corpo a produrre anticorpi specifici che uccidono le cellule tumorali o bloccano le vie metaboliche di destinazione, raggiungendo l'obiettivo di curare malattie.
Basandosi su una piattaforma di servizi "ricombinante per proteine", Yaohai Bio-Pharma può fornire ai clienti una soluzione chiave in mano, dallo sviluppo del ceppo e dalla preparazione di campioni proteici alla produzione GMP di vaccini proteici ricombinanti. Possiamo adattare flessibilmente il processo di servizio in base alle esigenze personalizzate, fornendo ai clienti sostanze farmaceutiche (DS) o prodotti farmaceutici (DP) a base di proteine ricombinanti di alta qualità in quantità di grammi o decine di grammi, nonché documenti di sviluppo del processo e registrazioni di produzione GMP e rapporti di test.
Yaohai Bio-Pharma Offre una Soluzione CDMO Tutto-in-Uno per Proteine Ricombinanti
I servizi di vaccini terapeutici a base di proteine/peptide ricombinanti offerti da Yaohai Bio-Pharma si basano anch'essi sulla Piattaforma di Servizi per Proteine Ricombinanti]. Per maggiori dettagli sul servizio, fare riferimento al " Soluzioni CDMO per Vaccini a Sottounità Ricombinanti ".
Consegne
| Grado |
Consegne |
Specifiche |
Campioni di Applicazioni |
| Non-GMP |
Sostanza farmaceutica |
0.2~10 g |
Studi preclinici, Sviluppo di metodi analitici, Studi pre-stabilità, Sviluppo di formulazione |
| Prodotto farmaceutico |
| GMP, Sterile |
Sostanza farmaceutica |
2~100 g |
Nuovo farmaco sperimentale (IND), autorizzazione per il trial clinico (CTA), fornitura per trial clinici, fornitura commerciale |
| Prodotto farmaceutico |
20.000 fiale (liquido o liofilizzato), siringhe pre-riempite o cartucce |
Studio di caso
| Tipi |
Esigenza del cliente |
Consegne |
| Vaccino terapeutico a proteina ricombinante |
Controllare il rischio di trasferimento tecnologico e ottenere un processo di produzione stabile della sostanza attiva; Fornire una sostanza attiva a base di proteine ricombinanti in quantità multigrammi; Assicurarsi che le attività di produzione rispettino tutte le specifiche GMP. |
• Sostanza attiva a base di proteine ricombinanti che soddisfa gli standard di qualità.
• Certificato di analisi della sostanza attiva, specifiche del processo, standard di qualità, registrazioni di produzione e altri documenti che sono completamente conformi alle norme GMP
|
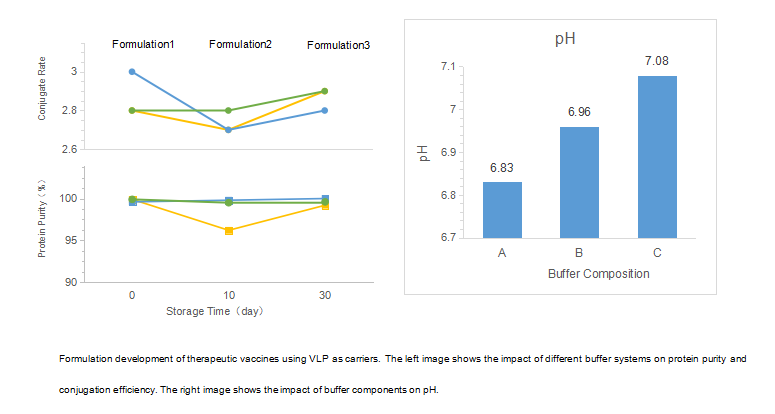
| Vaccino terapeutico con VLP come vettore |
Sostanza farmaceutica: L'accoppiamento del antigene-proteina portatrice VLP viene eseguito in un laboratorio GMP. Prodotto farmaceutico: Sviluppo della formulazione e riempimento sterile. |
• Consegnare una formulazione stabile della sostanza farmaceutica e del prodotto farmaceutico (inclusi gli adiuvanti) e un processo di produzione del prodotto farmaceutico scalabile. • La produzione dell'accoppiamento è in corso |
| Soluzioni correlate: Soluzioni CDMO per Proteine Portatrici |

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NO
NO
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN


