تكوين الحمض النووي الريبوزي المرسال خارج الجسم
المكونات الرئيسية للحمض النووي الريبوزي المرسال هي غطاء 5'، منطقة غير مترجمة قبل المقطع المفتوح للقراءة (5'-UTR)، الإطار المفتوح للقراءة (ORF)، منطقة غير مترجمة بعد المقطع المفتوح للقراءة (3'-UTR)، والذيل متعدد الأدينين (poly A tail)، وهي ضرورية لحفظ وظائف mRNA. استخدم الباحثون مجموعة من الأساليب لاكتشاف وتحسين تسلسلات وبنية mRNA.
يتم إنتاج الحمض النووي الريبوزي المرسال باستخدام التفاعل النصحي خارج الجسم (IVT) مع قوالب الحمض النووي الخطي، وبوليميرازات RNA (T3، T7 أو SP6)، والنيوكليوتيدات الطبيعية أو المعدلة، والأنزيمات والمكونات المناسبة.
تعديل غطاء 5'
تظهر تسلسلات الحمض النووي الريبي الناضجة من الخلايا اليوكاريوتية قبعة تحتوي على مجموعة 7-ميثيلغوانوسين (m7G) في نهاية 5'، مما يحسن استقرار الحمض النووي الريبي وفعالية الترجمة. هناك طريقتان رئيسيتان لالتقاط الحمض النووي الريبي في المختبر. أولاً، يمكن إضافة نظير للقبعة لهيكل m7GpppG (على سبيل المثال، CleanCap) إلى نظام IVT أثناء كتابة الحمض النووي الريبي في المختبر، مما يؤدي إلى وضع القبعة بشكل طبيعي. توفر هذه الطريقة التي يتم فيها وضع القبعة أثناء الكتابة هيكل قبعة طبيعي بنسبة كفاءة تصل إلى حوالي 90-99%. ثانيًا، يمكن أيضًا تحقيق خرائط الحمض النووي الريبي من خلال réactions إنزيمية بعد عملية الكتابة في المختبر.
تعديل PolyA
ذيل البولي (أ) يمدد أيضًا عمر الرنا النصفي داخل الكائن الحي ويعزز كفاءة ترجمة الرنا. يجب أن يكون طول ذيل البولي (أ) المضخم بين 100-300 نوكليوتيد. بالإضافة إلى ذلك، يزيد الأدينوزين المُعدَّل من استقرار ذيل البولي أ ضد تحلل إنزيمات RNase الخلوية. يمكن إدراج ذيل البولي أ بواسطة الترجمة الخارجية باستخدام قالب الحمض النووي الذي يحتوي على تسلسل البولي أ، مما يؤدي إلى طول محدد لذيل البولي أ. كما يمكن استخدام بولي أ بوليمراساً إعادة التركيب بواسطة التعدد البوليزيماطي بعد عملية نسخ الرنا.
تعديل النوكليوتيدات
يمكن لأنواع النوكليوسيدات المعدلة أن تمنع التعرف على مستقبلات التعرف على الأنماط (PRR) و/أو تفعيلها وتعزز فعالية لقاحات mRNA بطريقةين مختلفتين تماماً. إضافة بعض النوكليوسيدات المعدلة كيميائيًا، بما في ذلك اليوريدين الزائف (ψ)، والميثيل-1-يوريدين الزائف (m1ψ)، والثيو-يوريدين (s4U) والسايتوسين-5-ميثيل (m5C)، يمكن أن تمنع تنشيط مستقبلات TLR7/8 وغيرها من مستقبلات المناعة الذاتية، مما يقلل بشكل كبير من مناعة mRNA.
نظام تسليم mRNA
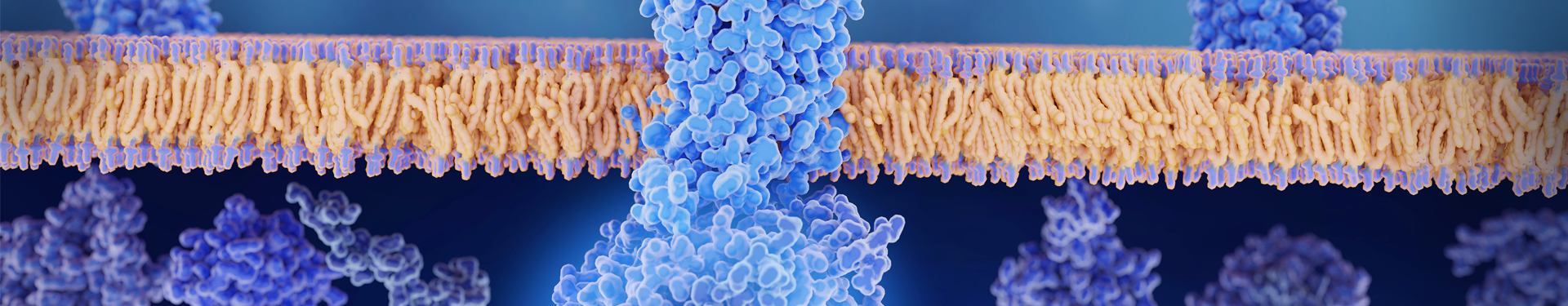
للحفاظ على وظيفة mRNA، يجب أن تدخل إلى السيتوبلازم المضيف وتُعبّر عن المستضدات المحددة. أحد التحديات الأكثر صعوبة التي تواجه لقاحات mRNA والعلاجات هو تسليم mRNA إلى الخلايا المستهدفة بمستويات ترجمة كافية، مما يتطلب أنظمة تسليم mRNA ذات كفاءة عالية ودقة كبيرة. تم تطوير واستخدام عدة متجهات لتسليم mRNA، تشمل خلايا الدنترويد (DCs)، البروتامين، البوليمرات الموجبة الشحنة، والليسوームات الموجبة الشحنة.
تجمعات الدهون الكهربائية الموجبة مع الحمض النووي الريبي المرسال (mRNA) وأخرى يمكن أن تشكل جزيئات نانوية بحجم يتراوح بين 80-200 نانومتر تُسمى الجزيئات النانوية الدهنية (LNPs). كواحدة من أكثر أنظمة تسليم mRNA تطورًا، تتضمن LNP دهون كهربائية موجبة قابلة للإيونية، وفوسفوليبيدات طبيعية، وكوليسترول، ومتعدد الإيثيلين غليكول (PEG). هناك عدة لقاحات RNA وعلاجات (siRNA وmRNA) تم اعتمادها من قبل إدارة الغذاء والدواء الأمريكية تعتمد على أنظمة تسليم LNP.
شركة Yaohai Bio-Pharma تقدم حلول شاملة للRNA
تسليمات مخصصة
|
الدرجة
|
النتائج المقدمة
|
المواصفات
|
التطبيقات
|
|
غير متوافق مع GMP
|
مادة دوائية، mRNA
|
0.1~10 مجم (mRNA)
|
البحث ما قبل السريري مثل زرع الخلايا، تطوير طرق التحليل، دراسات الاستقرار المبدئية، تطوير الصيغة
|
|
منتج الدواء، LNP-mRNA
|
|
GMP، التعقيم
|
مادة دوائية، mRNA
|
10 مجم ~ 70 غرام
|
طلب دواء جديد (IND)، ترخيص التجارب السريرية (CTA)، إمدادات التجارب السريرية، طلب ترخيص البيولوجيات (BLA)، الإمداد التجاري
|
|
منتج الدواء، LNP-mRNA
|
5000 قارورة أو محقن مسبقة الملء / خراطيش
|

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NO
NO
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN