Tipes van Antiliewe Fragmente
Konvensionele antiliewe afgeleides:
- Die ~50 kDa segment bekend as Fab (antigenbindingfragment) bestaan uit die swaar ketting VH en CH1 domeine chemies geheg aan die Ab ligte ketting (VL + CL) deur 'n disuulfiwbrug, wat monovalente en monospesifieke binding verseker. 'n Groot voordeel van die verskillende Fab is dat skakeling ingenieursnie werklik nie vereis word nie, wat tyd en hulpbronne bespaar. Fabs word gewoonlik gekoppel as doelwitligande vir terapeutiese of diagnostiese gereedskap.
- Die veranderlike domeine van 'n Ab se swaar (VH) en liggewig (VL) kettings word deur 'n skakelingpeptied saamgevoeg om die enkelvoudige kettingveranderlike fragment , of scFv, te vorm. Weens hul klein grootte het scFvs 'n kort halflewertyd van ongeveer 0.5-2.0 ure. Soos Fabs, word scFvs gebruik in die produksie van geneesmiddelkonjugeerte en gemikte kankerbeelddiagnose-trassere.
Kameelid swaartketting antiligfragmentafleidings:
-
Enkeldomeinantilig (sdAb) of swaartketting veranderlik (VHH), Nanobody (Nb) is die kleinste bekende kunsmatige antigen-spesifieke bindingfunksionele fragment, wat slegs ~15 kDa weeg. Nbs is hoogs stabiel, duurzaam en oplosbaar. Verder kan Nbs epitope binde wat volgrootte Abs nie kan bereik deur in klein holtes te gaan nie. Verder kan Nbs maklik geneties gewysig word om meervoudige en multispesifieke werktuie te skep wat effektief op wye skaal uitgedruk word met verskeie uitdrukkingsplatforms.
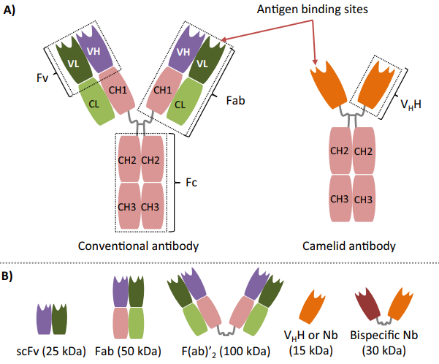
Fig 1. Struktuur van Konvensioneel en Kameelid swaartketting mAb afgelei fragments
Yaohai Bio-Pharma Bied Eenmalige CDMO Oplossing Vir Antiligafragmente
Verwysing:
[1] Alonso Villela SM, et al. Produksie van rekombinante skerpioenantigifte in E. coli: huidige toestand en perspektiewe. Appl Microbiol Biotechnol. 2023 Jul;107(13):4133-4152. doi: 10.1007/s00253-023-12578-1.
[2] Khilji SK, et al. Kleiner formaat slaan harder toe - Onlangse vordering in klein antiliggieslisse wat tuimelkariese koolhidraatantigene doelwit. Theranostics. 2023 Mei 15;13(9):3041-3063. doi: 10.7150/thno.80901.

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NO
NO
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN


