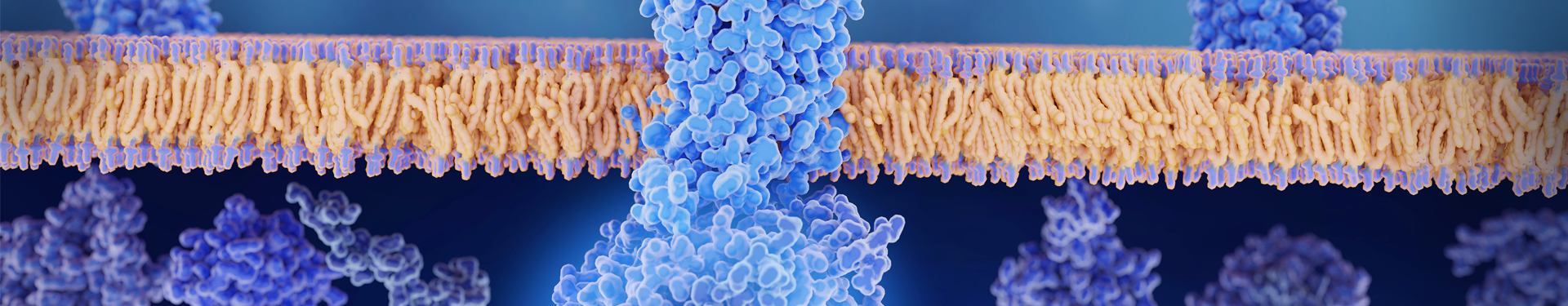
Caplacizumab (Cablivi) is een gehumaniseerd von Willebrand-factor (vWF) gericht nano-antilichaam, ook bekend als Single Domain Antibody (SdAb) of Heavy-Chain Variable (VHH). Caplacizumab werd zorgvuldig ontwikkeld door Ablynx (een dochteronderneming van Sanofi) en goedgekeurd voor de behandeling van patiënten met verworven trombotische trombocytopenische purpura (aTTP), een zeldzame aandoening die wordt gekenmerkt door abnormale bloedstolling in de kleine bloedvaten. Caplacizumab richt zich op het A1-domein van vWF, blokkeert de interactie ervan met de GpIb-IX-V-receptor van bloedplaatjes en voorkomt de vorming van bloedplaatjesrijke trombi.
Caplacizumab, een bivalent Nanobody, bestaat uit twee homologe gehumaniseerde eenheden die met elkaar verbonden zijn door een drie-alanine-linker. Het komt tot uiting in Escherichia coli (E. coli) door middel van recombinant-DNA-technologie, resulterend in een molecuulgewicht van ongeveer 28 kDa.
Caplacizumab is het eerste goedgekeurde geneesmiddel dat zich richt op vWF en de behandeling van verworven trombotische trombocytopenische purpura (aTTP). Het onderscheidt zich ook doordat het het eerste goedgekeurde antilichaam met één domein is, wat een opmerkelijke mijlpaal markeert in kleine biologische geneesmiddelen.
Belangrijkste mijlpalen van Caplacizumab
Caplacizumab werd aanvankelijk ontdekt door Ablynx, een biotechnologiebedrijf opgericht in 2001 gespecialiseerd in de ontwikkeling en commercialisering van ‘nanobodies’ in lama’s en andere kameelachtigen. In een strategische zet voltooide Sanofi in januari 2018 de overname van Ablynx voor €3.8 miljard, waarmee ze de overwinning behaalde op concurrent Novo Nordisk, die meerdere biedingen op het bedrijf had gedaan.
De werkzaamheid en veiligheid van caplacizumab werden beoordeeld aan de hand van positieve eindpunten bij patiënten met verworven trombotische trombocytopenische purpura (aTTP) tijdens zowel het fase 2-TITAN-onderzoek als het daaropvolgende fase 3-HERCULES-onderzoek.
In 2018 verleende het Europees Geneesmiddelenbureau (EMA) zijn eerste goedkeuring voor caplacizumab, in combinatie met plasma-uitwisseling en immunosuppressie, voor de behandeling van volwassenen die een episode van aTTP doormaken.
In februari 2019 werd deze regelgevende mijlpaal gevolgd door goedkeuring van de Amerikaanse Food and Drug Administration (FDA), waarbij Sanofi's Caplacizumab voor de behandeling van aTTP werd goedgekeurd.
Yaohai Bio-Pharma biedt one-stop-CDMO-oplossing voor VHH/sdAb
Anti-vWF VHH-pijpleiding
|
Generieke naam
|
Merknaam/alternatieve naam
|
Expressiesysteem
|
Indicaties
|
Fabrikant
|
R&D-fase
|
|
Caplacizumab-YHDP
|
ALX-0081, ALX-0681, Cablivi, カブリビ
|
Escherichia coli
|
Verworven trombotische trombocytopenische purpura (aTTP)
|
Ablynx NV, Sanofi
|
Goedkeuring van de miner
|
Referentie:
[1] Duggan S. Caplacizumab: eerste wereldwijde goedkeuring. Drugs. 2018 okt;78(15):1639-1642. doi: 10.1007/s40265-018-0989-0.
[2] Morrison C. Nanobody-goedkeuring geeft domeinantilichamen een boost. Nat Rev Drug Discov. 2019 juli;18(7):485-487. doi: 10.1038/d41573-019-00104-w.

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NEE
NEE
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN