Gemäß dem zentralen Dogma ist die Messenger-RNA (mRNA) die Brücke für die Übertragung des genetischen Materials von der DNA auf die Proteine.
mRNA spielt eine biologische Rolle, indem sie Proteine in vivo kodiert, und reife mRNA in eukaryotischen Organismen besteht aus fünf Komponenten: 5'-Cap (Cap-Struktur), 5'-UTR (nicht-kodierende Region), ORF (offener Leserahmen), 3'-UTR und 3'-PolyA-Schwanz (Polyadenylatschwanz).
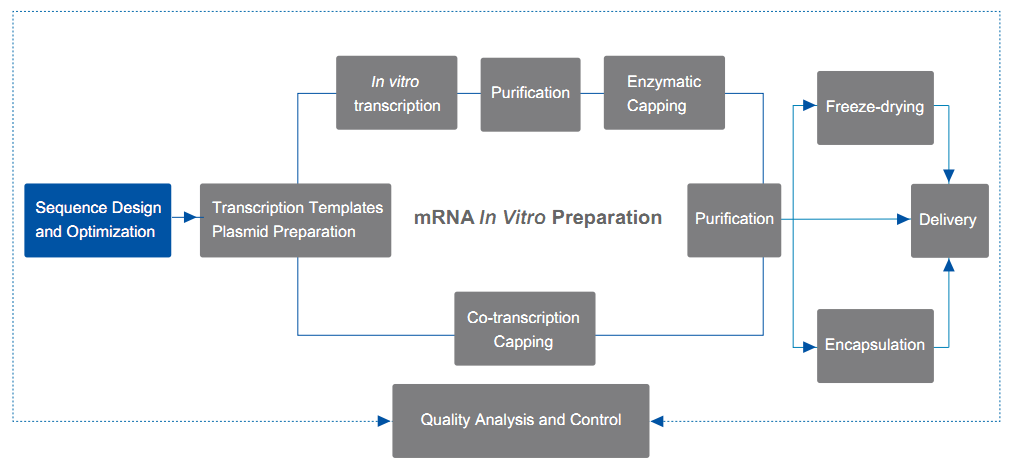
Details zu den Dienstleistungen
| Prozess |
Optionaler Service |
Service Details |
Lieferzeitraum (Tag) |
| mRNA-Sequenzdesign und -optimierung |
Design und Optimierung von Codierungssequenzen |
CDS-Sequenzausrichtung
CDS-Codon-Optimierung
|
1 |
| Design und Optimierung nichtkodierender Sequenzen |
5'-UTR-Sequenzdesign und -optimierung
3'-UTR-Sequenzdesign und -optimierung
Design und Optimierung von PolyA-Sequenzen
|
1 2 |
Anpassbare Optionen
| 5' UTR/3' UTR |
- Nature UTR-Sequenz
- Mutierte/konstruierte UTR-Sequenz
|
| 3' PolyA-Schwanz |
- 100 A ~ 120 A Endstück (empfohlen)
- Segmentierter PolyA-Schwanz
- Anderes Custom-Heck
|
Gängige Strategien für das mRNA-Sequenzdesign
| mRNA-Komponenten |
Biologische Funktionen |
Optimierungsstrategien |
| 5' Kappe |
Schützt mRNA vor dem Abbau durch Exonukleasen und wirkt zusammen mit dem PolyA-Schwanz am 3'-Ende, dem PolyA-Bindungsprotein und dem Translationsinitiationsfaktor-Protein, um die Proteintranslation zu initiieren. |
Die natürliche Cap1-Struktur vermeidet Mustererkennungsrezeptoren und reduziert somit die natürliche Immunantwort, was durch eine einstufige co-transkriptionelle Kappe oder eine zweistufige enzymatische Kappe erreicht werden kann (Einzelheiten finden Sie unter mRNA-enzymatische Kappe und co-transkriptionelle Kappe). |
| 5' UTR |
Die 5'-UTR kann von Ribosomen erkannt werden, reguliert die Translation von mRNA und beeinflusst die Stabilität von mRNA. |
Enthalten Kozak-Sequenzen ohne sehr stabile Sekundärstruktur. Natürliche UTRs hochexprimierter Gene werden für In-vitro-Transkription (IVT)-mRNAs wie α-Globin und β-Globin bevorzugt. |
| CDS |
Proteinkodierende Regionen und kodierende Sequenzen für Antigene, Antikörper oder andere funktionelle Proteine. |
Durch die Codon-Optimierung wird der Translationsgrad erhöht, wobei zu beachten ist, dass bestimmte nicht optimale Codons bei der Proteinfaltung eine Rolle spielen können. |
| 3' UTR |
Reguliert die mRNA-Translation und -Stabilität. |
Natürliche UTRs von hochexprimierten Genen wie α-Globin und β-Globin werden für IVT-mRNAs bevorzugt. |
| 3' PolyA-Schwanz |
Regulieren Sie die Proteinexpression und schützen Sie die Kappenstruktur vor Abbau. |
Eine angemessene Länge (100–150 bp) ist erforderlich. Durch die Kodierung des PolyA-Schwanzes auf dem Transkriptions-Vorlagenplasmid wird eine besser definierte Länge des PolyA-Schwanzes gewährleistet. |
Unsere Eigenschaften
- Diversifizierte UTR-Quellenauswahl
Mehrere Quellen hochexprimierter natürlicher und modifizierter UTR-Bibliotheken; ausgereifte UTR-Modifizierungsstrategie;
- Hochmodernes CDS-Optimierungsteam
Arbeiten Sie mit einem professionellen KI-Algorithmenteam zusammen, um die Optimierung der Codons abzuschließen.
- Gleichmäßige PolyA-Schwanzverteilung
Fügen Sie PolyA-Sequenzen gemäß DNA-Vorlagen hinzu, um die mRNA-Länge präziser zu steuern.
- Diversifizierte Optimierungskombinationen
Erreichen Sie eine effiziente Expression von mRNA mit geringer Immunogenität.
Fallstudie
Sequenzdesign einer Dual-Reporter-mRNA: mCherry-eGFP-mRNA
Der mRNA-Service von Yaohai Bio-Pharma wird durch die Entwicklung und Optimierung einer Doppelreportergen-Tandemsequenz, die eine Koexpression dualer Gene ermöglicht, kontinuierlich verbessert.
Mithilfe eines herkömmlichen Transfektionsreagenz wird die Doppelgen-Tandemsequenz mCherry-eGFP-mRNA in 293T-Zellen transfiziert und nach 48 Stunden werden zwei Fluoreszenzsignale von mCherry (rot) und verstärktem grün fluoreszierendem Protein (eGFP) mit gleichzeitiger Expression erkannt, und das gestapelte Diagramm ist gelb hervorgehoben.

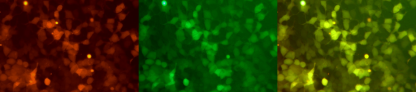
Expression von mCherry-eGFP-mRNA in 293T-Zellen

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NEIN
NEIN
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN