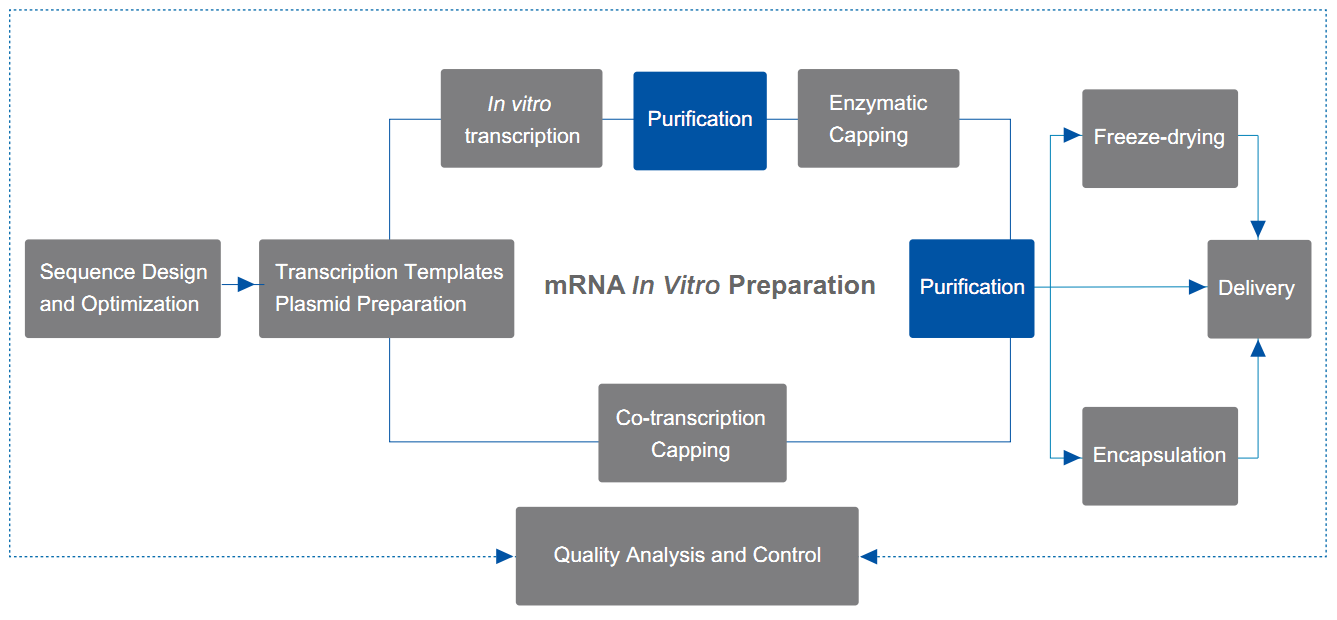
Die durch In-vitro-Transkription (IVT) und Capping-Reaktionen hergestellte mRNA muss weiter gereinigt werden, um während der IVT- und Capping-Reaktionen nicht verbrauchte Substrate und Nebenprodukte zu entfernen und so die Wirksamkeit und Sicherheit von mRNA-Impfstoffen oder -Therapeutika sicherzustellen.
Yaohai Bio-Pharma bietet ausgereifte Lösungen für die LiCl-Fällung, die Reinigung mittels magnetischer Perlen und die chromatographische Reinigung, mit denen prozess- oder produktbedingte Verunreinigungen wirksam entfernt und reine mRNA hergestellt werden können.
Einfaches Reinigungsschema für kleine Mengen mRNA, das für die Zelltransfektion und einige Tierversuche verwendet werden kann; wird für die Reinigung vorgekapselter Proben nach der In-vitro-Transkription verwendet.
- Oligo dT-Reinigungsmethode mit magnetischen Perlen
Reinigungsschema für kleine Mengen mRNA, das für die Zelltransfektion und einige Tierversuche verwendet werden kann; wird für die Reinigung vorgekapselter Proben nach der In-vitro-Transkription verwendet.
- Chromatographische Reinigungsverfahren
Mehrere chromatographische Reinigungslösungen, wie Affinitätschromatographie, Ionenaustausch und hydrophobe Interaktionschromatographie (HIC), erfüllen die Anforderungen von Anwendungsszenarien mit höheren Qualitätsanforderungen, wie Zelltransfektion, LNP-Einkapselung usw.
Details zu den Dienstleistungen
Prozess |
Optionaler Service |
Service Details |
Lieferzeit (Werktage) |
Lieferbar |
mRNA-Reinigung |
Konventionelle Reinigungslösung |
Lithiumchlorid-Ausfällung |
1 |
mRNA-Wirkstoff |
| Magnetische Perlenreinigung |
| Hochreine Reinigungslösungen |
Affinitätschromatographie oder mehrere Chromatographiekombinationen |
2 |
| Pufferaustausch |
Ultrafiltration und Pufferaustausch |
1 |
mRNA-Qualitätskontrolle |
Konzentrationsmessung |
Ultraviolett-Spektrophotometrie (UV) |
0.5 |
Test Report |
| Integritäts- und Reinheitsprüfung |
Agarosegelelektrophorese (AGE) |
| Kapillarelektrophorese (CE) – optional |
1 |
Unsere Eigenschaften
- Eine Vielzahl optionaler Reinigungslösungen kann verschiedenen Anwendungsszenarien gerecht werden.
- Die Reinheit der mRNA kann routinemäßig über 95 % erreichen, wobei die höchste Reinheit 100 % erreicht.
- Verhindern Sie wirksam den mRNA-Abbau durch eine strenge Kontrolle der RNase in der Versuchsumgebung und den Verbrauchsmaterialien.
Fallstudie
Yaohai Bio-Pharma kann ausgereifte mRNA-Reinigungslösungen bereitstellen, mit denen verschiedene prozess- und produktbezogene Verunreinigungen wirksam entfernt werden können.
Nach der Kapillarelektrophorese (CE)-Erkennung kann die Reinheit der durch Chromatographie-Reinigung hergestellten mRNA-Probe mehr als 95 % erreichen, und die durch den Enzymimmunoassay (ELISA) nachgewiesene Rest-dsRNA beträgt weniger als 0.06 %. Die hohe Qualität erfüllt die Anforderungen der nachgelagerten Anwendungen von mRNA.
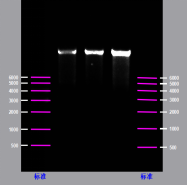
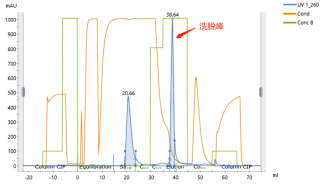
Maßgeschneiderte Reinigung von mRNA (>9kb)
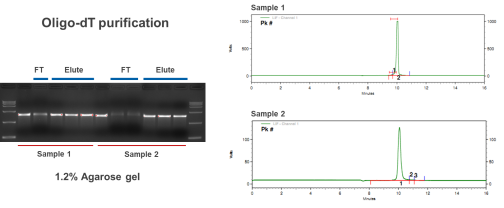
Die Reinheit der Spike SARS CoV-2 mRNA (mehr als 95%)

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NEIN
NEIN
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN