Personnalisation, Efficacité & Coût abordable
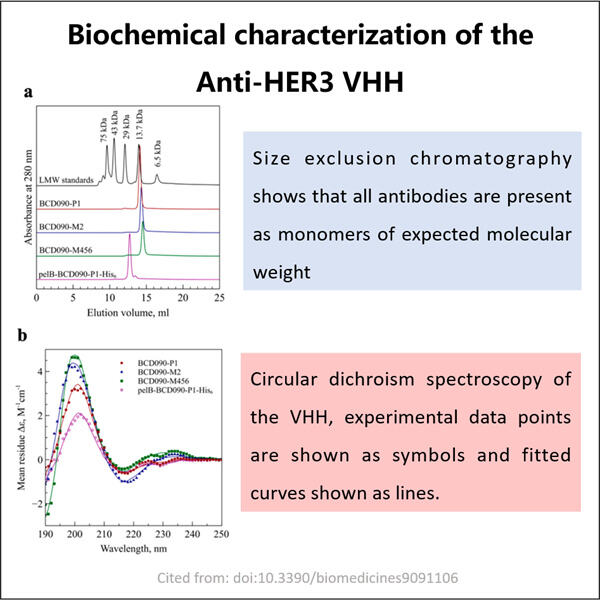
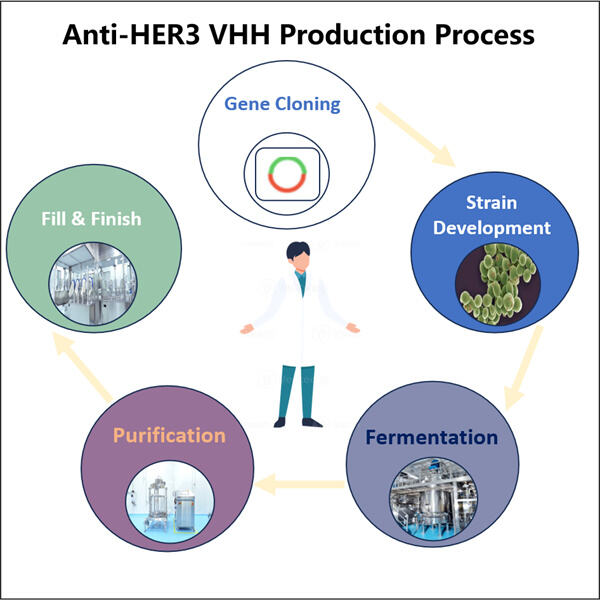
Yaohai Bio-Pharma a de l'expérience dans la fabrication de produits biologiques créés à partir de micro-organismes. Nous offrons des solutions R&D sur mesure ainsi que des services de production tout en minimisant les risques. Nous avons travaillé avec diverses modalités telles que les vaccins recombinants à sous-unités, les peptides, les hormones, les cytokines, les facteurs de croissance, les anticorps mono-domaine, les enzymes, l'ADN plasmidique, l'ARNm et d'autres encore. Nous nous spécialisons dans plusieurs micro-organismes comme les levures (sécrétion extracellulaire et intracellulaire, rendements jusqu'à 15g/L), les bactéries (solubles intracellulaires et corps d'inclusion, rendements jusqu'à 10g/L). Nous avons également développé un système de fermentation BSL-2 pour produire des vaccins GMP Anti-HER3 VHH. Nous sommes experts en optimisation des processus de production, en augmentation des rendements et en réduction des coûts. Nous disposons d'une équipe technologique très efficace qui garantit une livraison de projets rapide et de haute qualité. Cela nous permet de mettre vos produits uniques plus rapidement sur le marché.

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NO
NO
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN