در مقایسه با پوشش آنزیمی دو مرحله ای، روش رونویسی همزمان یک مرحله ای می تواند به طور قابل توجهی جریان فرآیند را کاهش دهد. این روش نتیجه گرا است و شامل افزودن آنالوگ های کلاهک به واکنش رونویسی در شرایط آزمایشگاهی (IVT) است. آنالوگ های کلاهک را می توان در شروع رونویسی معرفی کرد و mRNA با ساختار کلاهک را می توان پس از تکمیل رونویسی به دست آورد. آنالوگ های کلاهک نسل سوم فعلی می توانند از دربندی معکوس جلوگیری کنند و ساختار Cap 1 را مستقیماً به محصول رونویسی اضافه کنند.
برای ملاحظات mRNA in vivo ایمنی زایی و کارایی ترجمه، فرآیند IVT اغلب انواع خاصی از NTPهای اصلاح شده را اتخاذ می کند و نوکلئوتیدهای اصلاح شده رایج عبارتند از pseudouridine (Ψ)، N1-methyl-pseudouri-dine (N1Ψ) و 5-methylcytosine (5mC) .
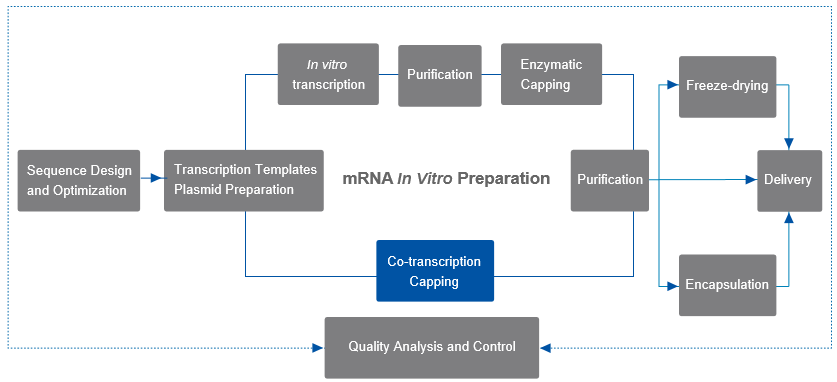
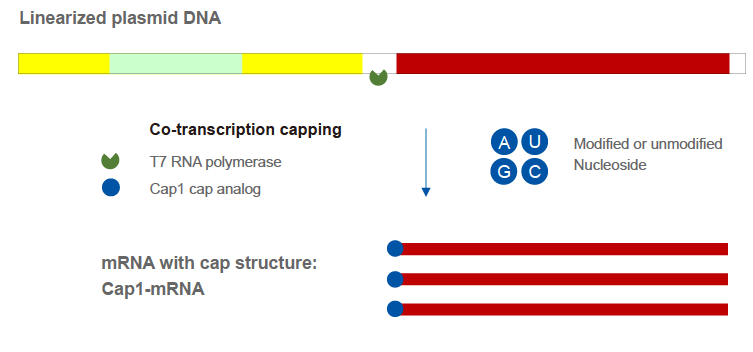
شکل: نمودار واکنش همزمان رونویسی و پوششی mRNA
محصولات |
جزئیات خدمات |
مدت تحویل (روز کاری) |
درپوش رونویسی مشترک |
پاسخ رونویسی در شرایط آزمایشگاهی (آنالوگ Clean Cap) | 1-2 |
| تغییرات نوکلئوتیدی (Ψ/N1Ψ/5mC) | ||
| حذف الگوی DNA (DNase I) | ||
بهینه سازی شرایط IVT - اختیاری |
طراحی و بهینه سازی اجزای واکنش | 3-7 |
چندین استراتژی اصلاح نوکلئوتید اختیاری می تواند بیان پروتئین را بهبود بخشد.
دستیابی به نسبت رونویسی بالا و راندمان پوشش بالا.
دستیابی به نرخ سقفی بیش از 95٪.
با کنترل دقیق RNase در محیط آزمایشی و مواد مصرفی، به طور موثر از تخریب mRNA جلوگیری کنید.
Yaohai Bio-Pharma با استفاده از آنالوگ های کلاهک تمیز برای افزودن مستقیم ساختار Cap1 در حالی که از دربندی معکوس اجتناب می کند، یک پلت فرم فرآیند درپوش رونویسی مشترک ساخته است. پس از پیش تیمار استاندارد شده نمونه و تشخیص الکتروفورز مویرگی (CE)، نرخ پوشش mRNA پروتئین فلورسنت سبز افزایش یافته (eGFP) می تواند به بیش از 95٪ برسد.
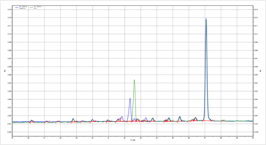
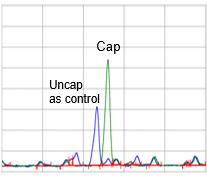
راندمان پوشش mRNA eGFP بیش از 95٪
mRNA ژن eGFP و mCherry که توسط درپوش رونویسی همزمان تهیه شده اند به ترتیب به سلول های 293T ترانسفکت می شوند و یک سیگنال فلورسنت قوی پس از 48 ساعت مشاهده می شود که نشان می دهد mRNA به طور موثر در سلول های 293T بیان می شود.

بیان mRNA ژن eGFP و mRNA ژن mCherry در سلول 293T