Ý nghĩa của Phát triển Quy trình Dòng Xuống (DSP)
Toàn bộ dịch lên men chứa protein mục tiêu hoặc plasmid, cũng như các tạp chất liên quan đến sản phẩm và quy trình, ví dụ như các hợp chất tụ tập, chất nền tế bào vi sinh, Protein Tế bào Chủ (HCP), DNA Tế bào Chủ (HCD), endotoxin, và kháng sinh.
Do đó, việc thiết kế một quy trình DSP hiệu quả, quá trình tinh chế, để loại bỏ các tạp chất nhất định và sản xuất ra chất dược phẩm có độ tinh khiết cao và chất lượng tốt là vô cùng quan trọng. Ngoài ra, tối ưu hóa quá trình tinh chế có thể giúp tăng tỷ lệ thu hồi sản phẩm, giảm chi phí, và cải thiện khả năng mở rộng và tái tạo quy trình.
Từ khóa: phát triển quy trình, tối ưu hóa và xác nhận, quá trình tinh chế, sắc ký, loại bỏ tạp chất, loại bỏ HCP, loại bỏ HCD, loại bỏ endotoxin, biến tính và tái gấp protein, lắp ráp VLP, nối kết
Ứng dụng: Ngành công nghiệp sinh dược, y học con người, y học thú y, vắc xin, sinh phẩm phân tử lớn tái tổ hợp, sinh phẩm tái tổ hợp, chất làm việc sinh học
Giải pháp DSP của Yaohai Bio-Pharma
Chúng tôi có kinh nghiệm rộng rãi trong việc cô lập protein hoặc plasmid mục tiêu từ các ma trận phức tạp bằng cách phát triển và tối ưu hóa quy trình tinh chế phía sau. Có nhiều loại hoạt động đơn vị khác nhau phù hợp cho việc tinh chế sinh phẩm, bao gồm ly tâm, lọc, đồng nhất hóa, phân rã kiềm, siêu lọc, kết tủa, biến tính protein và tái tạo, sắc ký, v.v.
Các dịch vụ phát triển tinh chế sẵn có của chúng tôi bao gồm:
- Phát triển toàn bộ quá trình tinh chế từ thu thập tế bào hoặc dịch nuôi cấy đến thành phần hoạt chất cuối cùng.
- Tối ưu hóa quy trình tinh chế dựa trên các tạp chất liên quan đến sản phẩm và quy trình để tăng chất lượng và độ an toàn của sản phẩm, ví dụ như HCP, HCD, endotoxin.
- Xác định và tối ưu hóa các thông số chính trong một hoặc nhiều hoạt động đơn vị, bao gồm phá vỡ tế bào, lọc dòng chảy tiếp tuyến, sàng lọc resin, sắc ký, biến tính protein và tái gấp, v.v.
- Tối ưu hóa quy trình về mặt chất lượng, năng suất, tỷ lệ thu hồi, chi phí và khả năng mở rộng.
- Xác nhận quá trình tinh chế phía downstream.
- Đánh giá phạm vi thông số dựa trên rủi ro và Thiết kế Thí Nghiệm (DoE) trong mô hình hóa quy trình.
Chi Tiết Dịch Vụ
Các nền tảng tinh chế protein hoặc plasmid chuẩn dựa trên nhiều bước tinh chế thô và ít hơn 4 bước sắc ký, bao gồm bắt giữ, tinh chế trung gian, và hoàn thiện.
| Chi Tiết Dịch Vụ |
Hoạt động Đơn vị |
Thông số |
| Tinh chế Thô |
Ly tâm |
Tốc độ quay, Thời gian |
| Đồng nhất hóa Áp lực Cao |
Tổng lượng chất rắn, Áp suất, Chu kỳ |
| Phương pháp li giải kiềm liên tục |
Tỷ lệ tế bào tái treo so với dung dịch li giải, Thời gian li giải |
| Lọc dòng chảy tiếp tuyến |
Chất liệu màng và kích thước lỗ, Tốc độ dòng chảy của vật liệu đầu vào Áp suất xuyên màng (TMP), Tỷ lệ thể tích lọc qua diện tích màng |
| Tụ tập |
Loại và nồng độ chất tụ tập, Chất phụ gia, pH, Nhiệt độ, Thời gian |
| Biến tính và tái gấp |
Hoà tan protein khối bao gồm |
Nồng độ chất biến tính (ví dụ: Ure, Guanidine HCl, Detergent ion mạnh), Detergents (ví dụ: Sodium dodecyl sulfate, SDS), Chất khử (ví dụ: Dithiothreitol, DTT), Chất tạo phức (Ethylenediaminetetraacetic acid, EDTA), Nhiệt độ, Thời gian |
| Sự tái gấp protein |
Các phương pháp tái gấp (phân loãng, thẩm phân hoặc tái gấp SEC), Nồng độ protein, Các chất đệm, pH, Nhiệt độ, Thời gian, Các tác nhân oxi hóa và khử (chẳng hạn như Glutathione, GSH/Oxit hóa Glutathione, GSSH, DTT/GSSH, Cysteine/Cystine), Các chất phụ gia phân tử nhỏ (L-arginine, Ure, Guanidine/HCl, và các chất tẩy rửa) |
| Bắt giữ, Tinh chế trung gian, và Hoàn thiện |
AC (Lọc hấp phụ) |
Một số loại nhựa/matrice lọc cột (chẳng hạn như AC, IEX, HIC, SEC, RPC, MMC), Chiều dài và đường kính cột, Thành phần chất đệm, Thể tích tiêm, Thành phần pha động (Quá trình hấp thụ và giải hấp), pH, Tốc độ dòng chảy, Điều kiện gắn kết, Rửa, và Elution. |
| IEX (Lọc trao đổi ion Anion hoặc Cation) |
| HIC (Lọc tương tác thuỷ phobic) |
| Loại muối và/hoặc lọc loại trừ kích thước (SEC) |
| RPC (Lọc pha ngược) |
| MMC, Lọc chế độ hỗn hợp |
Nghiên cứu trường hợp
Vụ 1
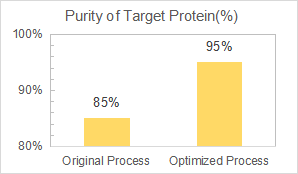
Chúng tôi được ủy thác phát triển và tối ưu hóa quy trình tinh chế phía sau để tăng độ tinh khiết của protein từ 85% lên 90% trong khi giảm các bước sắc ký.
Yaohai đã cung cấp một quy trình tinh chế mạnh mẽ và có thể mở rộng với 3 bước sắc ký cho protein mục tiêu, là một dị ứng bacterial. Và độ tinh khiết cuối cùng đạt đến 95%.
Vụ 2
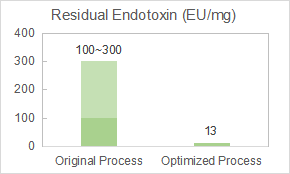
Yaohai đã được khách hàng của chúng tôi chỉ định để tối ưu hóa quy trình loại bỏ endotoxin của vắc-xin hạt giống virus (VLP).
Đội ngũ của chúng tôi đã thực hiện tối ưu hóa tham số sắc ký và chuẩn bị một chất hoạt chất thuốc với độ tinh khiết 98% và lượng endotoxin còn lại là 12.8EU/mg.
Kinh nghiệm của chúng tôi
- Chúng tôi đã tham gia vào việc phát triển và sản xuất nhiều phân tử lớn khác nhau, bao gồm vắc-xin tiểu đơn vị tái tổ hợp, VLPs, hormone (insulin, GLP-1, hormone tăng trưởng), cytokine (Interleukin-2/IL-2, IL-15, IL-21), yếu tố tăng trưởng (EGF, FGF, NGF), nanobody/antibody đơn miền (sdAbs), enzyme, v.v.
Thiết bị
Chúng tôi sử dụng các hệ thống tiên tiến trong ngành là AKTA Pure, AKTA Avant và HPLC chuẩn bị để thực hiện các phương pháp sắc ký khác nhau, bao gồm sắc ký tương tác cộng hưởng, trao đổi ion, tương tác kỵ nước, ngược pha và sắc ký loại trừ theo kích thước.




 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NO
NO
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN






