Vâng, Yaohai là một công ty sáng tạo trong lĩnh vực phát triển chẩn đoán bệnh cũng như các chiến lược điều trị (bao gồm y học cá nhân hóa) cho chúng. Có một căn bệnh được biết đến với tên gọi Virus viêm gan B hoặc HBV. Trước hết, để hiểu cơ chế nó hoạt động như thế nào để giúp ích Sản xuất Anti-vWF VHH , chúng ta cần phải biết HBV là gì và nó làm gì bên trong cơ thể chúng ta?
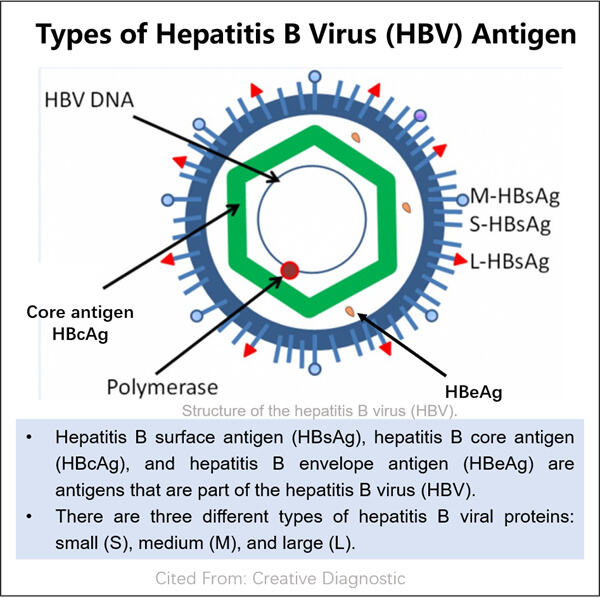
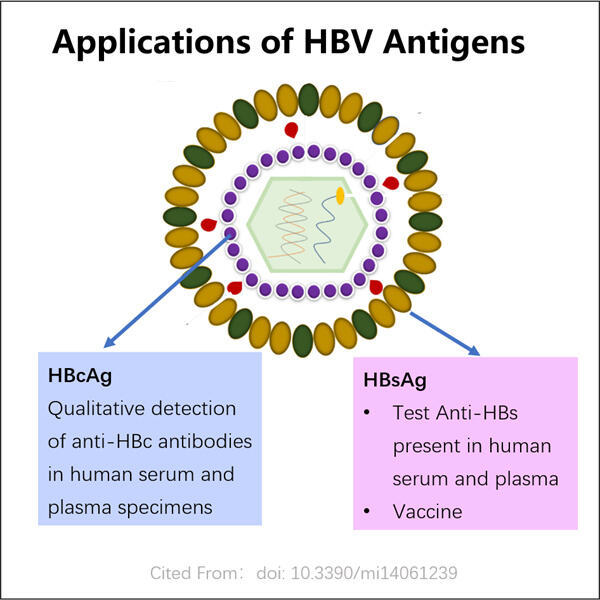
Viêm gan B (HBV) là một loại virus gây tổn thương gan. Gan là cơ quan quan trọng trong cơ thể chúng ta, tham gia vào việc tiêu hóa thức ăn và loại bỏ các chất có hại. Một người chạm vào máu hoặc dịch cơ thể của người bị nhiễm bệnh, và kết quả là bị lây nhiễm virus này, vốn lan truyền rất dễ dàng. Nếu ai đó mắc HBV, virus sẽ phát triển và nhân lên trong tế bào gan của họ. Nó tạo ra kháng nguyên khi sao chép. Kháng nguyên thực chất là protein, vì vậy chúng khá đặc trưng và có thể được nhận biết trong máu.

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NO
NO
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN