品質保証の一部である優れた製造基準 (GMP) は、プロセス、手順、文書化で構成されています。GMPは、医薬品がその使用目的に適した品質基準に基づいて一貫して製造および管理されることを保証します。
GMPグレードのバイオ医薬品の安定した供給と信頼性は、製品ライフサイクルのすべての段階、すなわちプレ臨床、第1相、第2相、第3相、商業段階において非常に重要です。
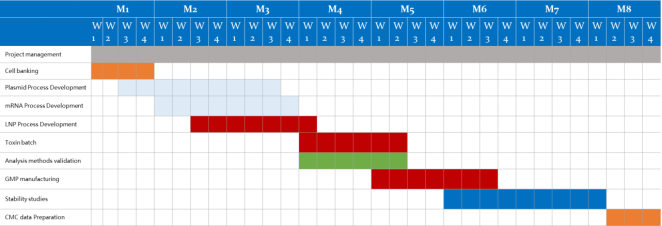
GMP 製造能力
|
等級 |
納品物 |
数量 |
アプリケーション |
|
非GMP |
mRNA DS |
0.1〜10 mg (mRNA) |
前臨床研究、転写、分析方法の開発、 配列開発 |
|
mRNA-LNP DP |
|||
|
GMP、無菌性 |
mRNA DS |
10 mg~70 g (mRNA) |
IND/CTA o r BLA/MAA 提出、 臨床試験および市販供給。 |
|
mRNA-LNP DP |
5000本のビアルまたはプリフィルドルインジェクターシリンジ/カートリッジ |
|
P プロセス |
サービスの詳細 |
単位操作 |
|
技術移転 |
文書の移管 |
プロセス、処方、分析方法および品質基準 |
|
技術およびコンプライアンス評価
|
人・機械・材料・方法・環境・測定の評価; プロセス、処方、分析方法および品質基準の評価。 |
|
|
技術移転の実施 |
製造プロセスおよび分析の移管 |
|
|
プロセスバリデーション |
1~3 工程 バッチ プロセスが堅牢であることを評価し、確認するためです。 |
|
|
プラミド製造 |
E. coli 発酵 |
発酵システムの準備 |
|
種菌 c 培養、連続添加発酵 |
||
|
プラミド精製 |
E. coli 細胞収穫およびアルカリ変性 |
|
|
プラミド精製、不純物除去 |
||
|
プラミド線状化 |
S 単一酵素消化 |
|
|
線状化されたテンプレートプラスミドの精製 |
||
|
mRNA DS製造 |
m RNA合成 |
体外で 転写 ( わかった VT) 反応 |
|
m RNA精製 |
D NAテンプレートの除去 |
|
|
mRNA精製、不純物の除去 |
||
|
m RNAバッファー交換 |
接線流れろ過 |
|
|
LNP DS マニュファクチャリング |
L NP カプセル化 |
リピドを含むエタノール相の準備 |
|
マイクロフローディクス技術 |
||
|
濃縮とバッファー交換 |
接線流れろ過 |