再構成タンパク質やペプチドなどのバイオ医薬品は、小分子医薬品よりも安定性が低いです。薬剤が安定した形で提供されない場合、第一相臨床試験(FIH)すら進まない可能性があります。
したがって、製造、輸送、長期保存、投与中の薬物の品質、効率、安定性を確保するためには、バイオライフサイクルにおけるフォーミュレーション開発が最も重要な要素の一つです。
キーワード: バイオ医薬品フォーミュレーションの開発と最適化、バイオ医薬品の剤型、薬物フォーミュレーション構成、プレフォーミュレーション研究、フォーミュレーション研究、フォーミュレーションスクリーニング
適用分野: 生物製薬産業、人用医薬品、動物用医薬品、ワクチン、再構成された大分子バイオ医薬品、生物製剤、生物学的試薬
液体およびリオフィライズ(凍結乾燥)された製剤は、現在バイオ医薬品の最も一般的な投与経路を代表しています。
ヤオハイ バイオファーマは、異なる投与経路向けに、ビアルまたはプレフィルトシリンジでの液状の薬物原体(DS)や製剤(DP)、およびリオフィライズされた製剤(DP)を開発することに特化しています。これは静脈内(IV)、皮下(SC)、硝子体(IVT)、および吸入(INH)投与を含みます。
私たちは、段階に適した製剤の開発と最適化のために、一回一因子法(OTAF)または実験計画法(DoE)を適用し、以下のステップを含んでいます:
| サービス詳細 | ユニット操作 | 私たちの焦点 |
| プレフォーミュレーション試験 | 物性化学的特性、安定性試験 | 早期または後期臨床試験に適したフォーミュレーション(例:液体、リオピライズド)を決定する |
| 液体のDSまたはDPフォーミュレーション | 高スループットの液体フォーミュレーションスクリーニング | バッファ組成、pH、イオン強度、安定剤、界面活性剤、賦形剤、添加剤など |
| リオピライズドDPフォーミュレーション | 高スループットのリオピライズドフォーミュレーションスクリーニング | 凍結乾燥保護剤(例えば、ショ糖、トレハロース)、バッファーシステム、賦形剤など |
| 液体DPのプロセス開発 | 添加剤の準備および滅菌技術 - オプション | 添加剤配合の安定性試験 |
| DS希釈およびDP準備 | 投与量、ポンピング試験、攪拌速度、せん断力 | |
| 充填および仕上げ | 充填量、混合試験、せん断力 | |
| 凍結乾燥プロセス開発 | 凍結乾燥サイクル開発 | 凍結乾燥DP品質 |
| 品質 検査 | 純度、完全性、溶解性、粘性、活性、集約性などについて。 | 処方構成およびプロセスがDS/DP品質に与える影響。 |
| 安定性試験 |
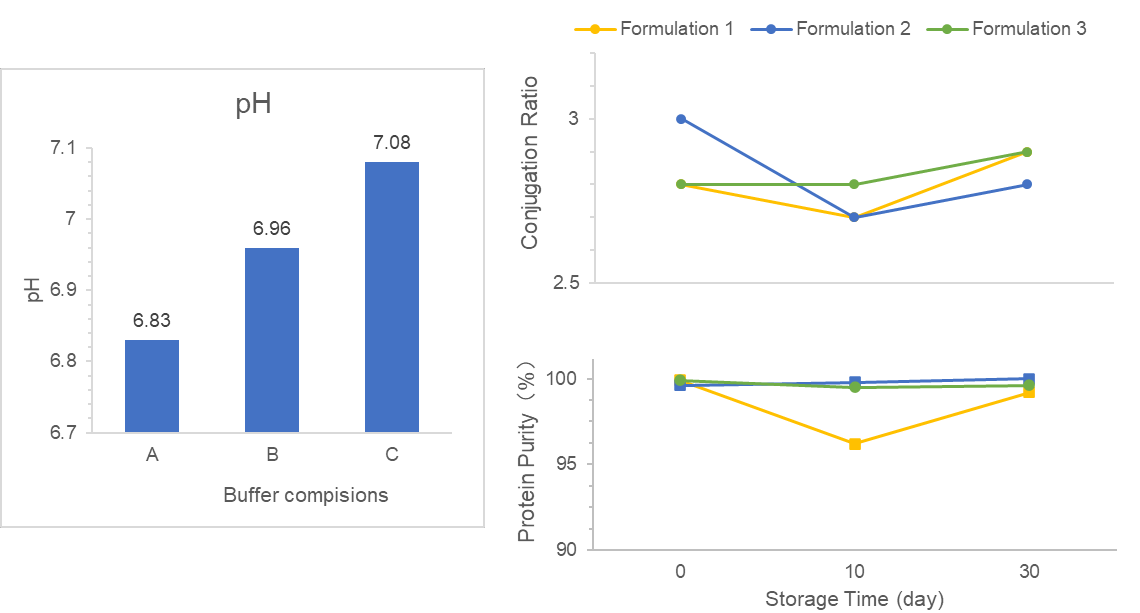
私たちは、VLP結合ワクチンのためのDS/DP処方のスクリーニングとDS/DPプロセスの設計を委託されています。
まず、所望の安定性、生物学的利用能、臨床安全性要件を満たす適切なバッファーをDS処方でスクリーニングしました。次に、抗原吸着レベルを向上させるために、添加剤ベースのDP処方におけるいくつかの要因を最適化しました。さらに、DS/DP品質に焦点を当てて、安定した製造プロセスを開発しました。