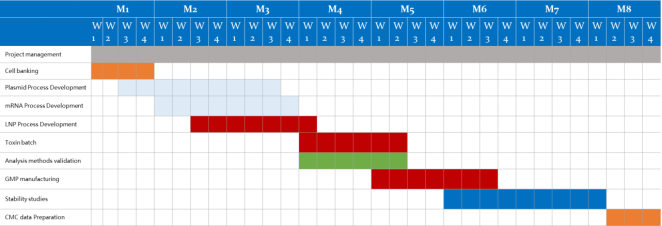
適正製造基準 (GMP) は、プロセス、手順、文書で構成される品質保証の側面です。 GMP は、医薬品が人や動物への使用目的に適した品質基準に従って一貫して生産および管理されていることを保証します。
GMP グレードの生物製剤の安定的かつ信頼性の高い供給は、前臨床、フェーズ 1、フェーズ 2、フェーズ 3、商業段階を含む製品のライフサイクルのすべての段階において極めて重要です。
GMP製造能力
|
学年 |
成果 |
数量 |
アプリケーション |
|
非GMP |
mRNA DS |
0.1~10mg(mRNA) |
前臨床研究、トランスフェクション、解析法開発、 製剤開発 |
|
mRNA-LNP DP |
|||
|
GMP、無菌性 |
mRNA DS |
10mg~70g(mRNA) |
インド/CTAor BLA/MAA 申請、 臨床試験および商用供給。 |
|
mRNA-LNP DP |
5000 バイアルまたはプレフィルドシリンジ/カートリッジ |
|
Pローセス |
サービス詳細 |
単位操作 |
|
技術移転 |
書類転送 |
プロセス、配合、分析方法および品質基準 |
|
技術的およびコンプライアンスの評価
|
人間・機械・材料・方法・環境・測定の評価。 プロセス、配合、分析方法、品質基準の評価。 |
|
|
技術移転の実施 |
製造プロセスと分析の転送 |
|
|
プロセス検証 |
1~3エンジニアリングバッチプロセスが堅牢であることを評価して確認します。 |
|
|
プラスミド製造 |
E. 大腸菌の発酵 |
発酵系の準備 |
|
シードc培養、流加発酵 |
||
|
プラスミドの精製 |
E. 大腸菌の細胞の採取とアルカリ溶解 |
|
|
プラスミドの精製、不純物の除去 |
||
|
プラスミドの線状化 |
S単一酵素消化 |
|
|
線状化されたテンプレートプラスミドの精製 |
||
|
mRNA DSの製造 |
mRNA合成 |
インビトロの転写(IVT) 反応 |
|
mRNA精製 |
DNA テンプレートの削除 |
|
|
mRNAの精製、不純物の除去 |
||
|
mRNAバッファー交換 |
タンジェンシャルフロー濾過 |
|
|
LNP DS製造 |
LNPカプセル化 |
脂質を含むエタノール相の調製 |
|
マイクロ流体技術 |
||
|
濃度と緩衝液交換 |
タンジェンシャルフロー濾過 |