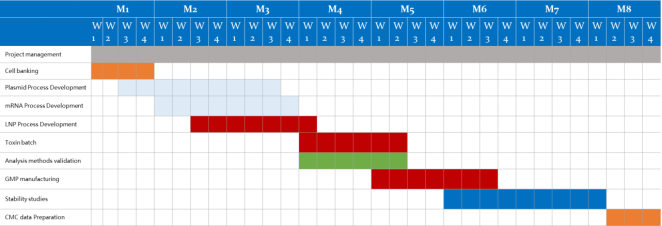
|
P rocznica
|
Szczegóły usług
|
Jednostka operacyjna
|
|
Przenoszenie technologii
|
Przesyłanie dokumentów
|
Proces, sformułowanie, metody analityczne i standard jakości
|
|
Ocena techniczna i zgodności
|
Ocena człowieka-maszyny-materiału-metody-środowiska-pomiaru;
Ocena procesu, sformułowania, metod analitycznych i standardu jakości.
|
|
Implementacja transferu technologicznego
|
Transfer procesu produkcyjnego i analizy
|
|
Walidacja procesu
|
1~3 inżynieria partie ocenić i potwierdzić, że proces jest solidny.
|
|
Produkcja plazmidów
|
E. coli fermentacja
|
Przygotowanie systemu fermentacji
|
|
Nasienie c kultivacja, fermentacja z podawaniem pokarmu
|
|
Czyszczenie plazmidów
|
E. coli zbieranie komórek i alkaliczne lizą
|
|
Czyszczenie plazmidów, usuwanie nieczystości
|
|
Linijność plazmidu
|
S jednoetapowa digestja enzymatyczna
|
|
Czyszczenie liniaryzowanego szablonowego plazmidu
|
|
produkcja mRNA DS
|
m Synteza RNA
|
W vitro transkrypcja ( I VT) reakcja
|
|
m Czyszczenie RNA
|
G Usunięcie szablonu NA
|
|
czyszczenie mRNA, usuwanie nieczystości
|
|
m Zamiana bufora RNA
|
Filtracja przepływem stycznym
|
|
Produkcja LNP DS
|
L Encapsulacja NP
|
Przygotowanie etanolowej fazy zawierającej lipidy
|
|
Technologia mikrofluidyczna
|
|
Koncentracja i wymiana buforu
|
Filtracja przepływem stycznym
|

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NO
NO
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN