Selon le dogme central, l'ARN messager (ARNm) est le pont pour la transmission du matériel génétique de l'ADN aux protéines.
l'ARNm joue un rôle biologique en codant des protéines in vivo, et l'ARNm mature chez les organismes eucaryotes se compose de cinq composants : le 5' Cap (structure cap), le 5' UTR (région non codante), l'ORF (cadre de lecture ouvert), le 3' UTR, et la queue 3' polyA (queue polyadénylée).
Détails des Services
| Process |
Service optionnel |
Détails du service |
Période de livraison (Jour) |
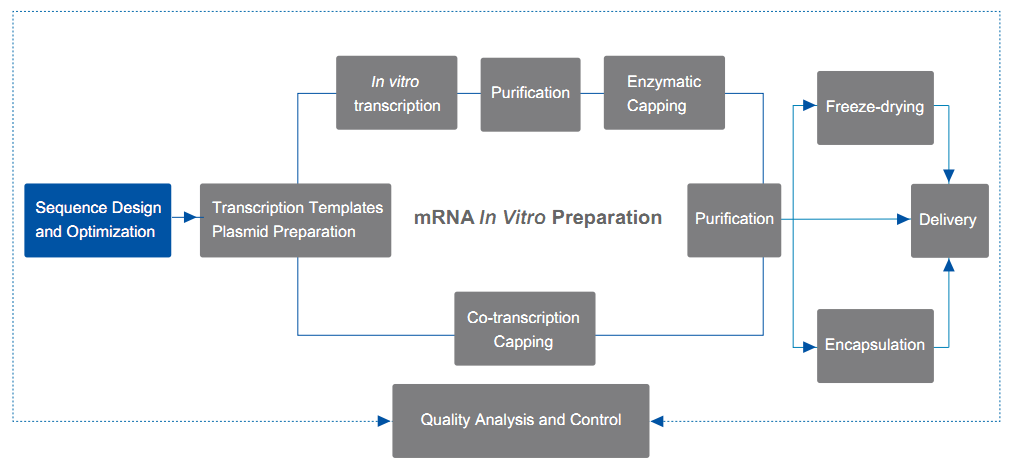
| conception et optimisation de la séquence d'ARNm |
Conception et optimisation des séquences codantes |
Alignement de la séquence CDS
Optimisation des codons CDS
|
1 |
| Conception et optimisation des séquences non codantes |
conception et optimisation de la séquence du 5' UTR
conception et optimisation de la séquence du 3' UTR
conception et optimisation de la séquence polyA
|
1-2 |
Options personnalisables
| 5’ UTR/3’ UTR |
- Séquence UTR naturelle
- Séquence UTR mutante/ingénierie
|
| queue polyA 3' |
- queue de 100A ~120A (recommandée)
- Queue polyA segmentée
- Autre queue personnalisée
|
Stratégies courantes pour la conception de séquences d'ARNm
| composants de l'ARNm |
Fonctions biologiques |
Stratégies d'optimisation |
| chapeau 5’ |
Protéger l'ARNm de la dégradation par les exonucléases et agir en synergie avec la queue polyA à l'extrémité 3', la protéine de liaison polyA et le facteur d'initiation de traduction pour initier la traduction des protéines. |
La structure naturelle du Cap1 évite les récepteurs de reconnaissance de motifs et réduit ainsi la réponse immunitaire naturelle, ce qui peut être réalisé par un chapeautage co-transcriptionnel en une étape ou un chapeautage enzymatique en deux étapes [voir chapeautage enzymatique de l'ARNm et chapeautage co-transcriptionnel pour plus de détails]. |
| région non codante 5' |
La région non codante 5' peut être reconnue par les ribosomes, réguler la traduction de l'ARNm et affecter la stabilité de l'ARNm. |
Contient des séquences Kozak sans structure secondaire très stable. Les UTR naturels des gènes hautement exprimés sont préférés pour la transcription in vitro (TIV) des ARNm, tels que l'α-globine et la β-globine. |
| CDS |
Régions codantes de protéines et séquences codantes pour les antigènes, anticorps ou autres protéines fonctionnelles. |
L'optimisation des codons augmente le niveau de traduction, en notant que certains codons non optimaux peuvent jouer un rôle dans le pliement des protéines. |
| 3' UTR |
Régulent la traduction de l'ARNm et sa stabilité. |
Les UTR naturels des gènes hautement exprimés sont préférés pour les ARNm synthétisés in vitro, tels que ceux de l'α-globine et de la β-globine. |
| queue polyA 3' |
Régulent l'expression des protéines et protègent la structure du cap contre la dégradation. |
Une longueur adéquate (100-150 paires de bases) est requise ; l'encodage de la queue polyA sur le plasmide modèle de transcription assure une longueur de queue polyA plus définie. |
Nos fonctionnalités
- Sélection diversifiée de sources UTR
Sources multiples de bibliothèques naturelles et modifiées d'UTR hautement exprimées ; stratégie de modification mature des UTR.
- Équipe d'optimisation CDS de pointe
Collabore avec une équipe d'algorithmes IA professionnelle pour terminer l'optimisation des codons.
- Distribution uniforme de la queue polyA
Ajoute des séquences polyA selon les modèles d'ADN pour contrôler plus précisément la longueur de l'ARNm.
- Combinaisons d'optimisation diversifiées
Réalise une expression efficace d'ARNm à faible immunogénicité.
Étude de cas
Conception de séquence d'un ARNm à double rapporteur : ARNm mCherry-eGFP
Le service d'ARNm de Yaohai Bio-Pharma continue d'être amélioré grâce à la conception et à l'optimisation d'une séquence en tandem de gènes à double rapporteur, qui permet la co-expression de deux gènes.
En utilisant un réagent de transfection conventionnel, la séquence en tandem de double gène mCherry-eGFP ARNm est transférée dans les cellules 293T, et deux signaux fluorescents de mCherry (rouge) et de protéine fluorescente verte renforcée (eGFP) sont détectés avec une expression simultanée après 48 heures, et le graphique superposé est mis en évidence en jaune.

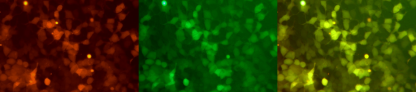
Expression de l'ARNm mCherry-eGFP dans les cellules 293T

 FR
FR
 EN
EN AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NO
NO
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN