GMP微生物細胞バンクのプロセスは、科学者が耐容性が高く効率的な薬を作り出すためのバイオ医薬品開発において欠かせません。ヤオハイによれば、それは強力な細胞バンクを持つことについてです。これらの細胞バンクは、これらの細胞から作られた薬が使用者に害を及ぼさないことを保証します。そこで、GMP微生物細胞バンクの概念についてさらに深く探り、それがあなたにとって何を意味するのかについてもっと知ってみましょう。
医薬品の開発は広く次に依存しています GMP Anti-MMRCD206 VHH 細胞バンキング。そのためには、グループが「良い」細胞を採取し、保存する必要があります。特に、さまざまな形の薬に変換できる細胞です。これらの細胞バンクは、実質的に細胞が保存され、凍結され、解凍される場所であり、成長記録ログにその細胞がどれだけの回数増殖したかが示されます。このデータは、科学者や薬を作っている人々にとって非常に重要な意味を持っています。これは、彼らが自らの装置を中断することなく継続して生産できるよう、細胞の可用性を保証することができるからです。
GMP微生物細胞バンクを使用して薬を作ることで何を得られるのでしょうか?これは効果的に生産時間を節約でき、それが主要な利点の一つです。なぜなら、これが複数の生産において細胞が一貫しているかどうかを確認できるからです。これは同じバッテリー内で一貫した細胞品質を確保することに相当します。品質管理は、治療法が実際に安全にあなたの元へ届くようにするために重要です。細胞バンクがあれば、医薬品製造業者は前回の在庫が不足し始めたときにすぐに次のバッチを生産することができます。これは、良いかつ定期的な医薬品の在庫があることを確実にするためです。
会社は特許取得済みの手順を確保し、その細胞を GMP CMV抗原製造 これらの細胞は、薬を作り出すために必要であるため、歯肉炎やその他の汚染物質から保護する必要があります。これは、清潔で無菌の環境で細胞が培養されることを意味します。また、その環境が清潔であり、潜在的な汚染物質がないことも意味しますよね?細胞は非常に低い温度で輸送や保存のために凍結保存されます。細胞バンクはさらに、保存中に細胞に悪影響を及ぼすもの(例えば、有害な細菌やウイルスなど)が入らないようにしなければなりません。このような注意を払うことは、細胞が純粋であり、いつでも使用できる状態であることを保証することを意味します。
薬が売られても 役に立たない前に 承認される必要があります 現在の良好製造慣行 (GMP) は,医薬品の製造中に遵守されなければならないガイドラインとプロセス規則の集合であり,すべてのものが安全で純粋で有効であることを確認しながら品質を確立するために使用されます. GMPガイドラインは FDA や EMA などの組織によって規制されています 薬の製造過程に 携わるすべての者が 正しく 処理されていることを確認します 携帯電話バンキングは 追跡可能なプロセスになります 携帯電話バンキングは 追跡可能なプロセスです 規制当局がすべてチェックし セキュリティ対策がすべて 遵守されていることを証明できる必要があります

初期文字 GMP HEV抗原生成プロセス 特定の環境/ホストから微生物の細胞をサンプリングして分離する際は、慎重に行います。これは汚染を避けて慎重に行われます。これらの細胞が分離されると、その成長と分裂を促進するユニークな環境で培養されます。研究者が最も適した細胞株を特定すると、それを凍結保存と呼ばれるプロセスで凍結します。

これらの細胞が凍結されると、セルバンクで-80°Cという最適な成長温度よりもずっと低い温度で保管され、何年も安定します。細胞は、クロスコンタミネーションを防ぐために特別に設計されたバイアルやカプセルなどの容器に入れられます。これにより、他の不要な細胞と混ざることはありません。施設が整った後、生産チームはセルバンクで保管されている在庫から必要な数の細胞を手配し、薬を作り始めるのです。
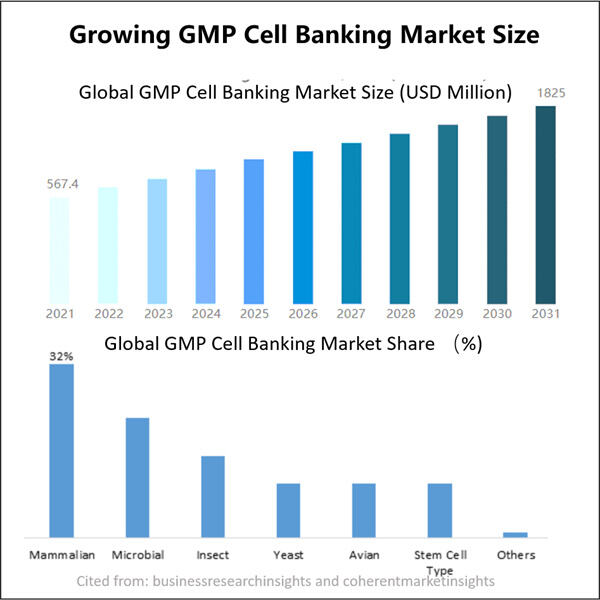
GMPマイクロバイアルセルバンキングは、微生物由来のバイオ医薬品のCDMO(契約開発製造機関)のリーダーです。我々の焦点は、ヒト、獣医学、ペット健康管理に適した微生物によって生産されるワクチンや治療薬にあります。最先端のR&Dプラットフォームと製造技術を有し、微生物株の開発からセルバンキング、プロセスおよび方法の開発、臨床および商業生産まで、全工程をカバーしています。これにより、革新的なソリューションの成功裏の提供が保証されます。私たちは長年にわたり、微生物を基盤とするバイオプロセスに関する広範な知識を蓄積してきました。200以上のプロジェクトを成功裡に完了しており、US FDAやEU EMAなどの規制適合性を確保するためのお客様の支援を行っています。また、オーストラリアのTGAや中国のNMPAへの対応もサポートします。私たちの専門知識と豊富な経験により、市場のニーズに迅速に対応し、カスタマイズされたCDMOサービスを提供できます。
GMP微生物細胞バンクのヤオハイ・バイオファーマは、規制事務と品質管理を統合しています。私たちは現在のGMP基準に準拠した品質システムを持ち、さらに世界中の規制にも対応しています。当社の規制チームは、世界的な規制フレームワークに精通しており、生物学的製品の上市を加速させます。私たちは、製造プロセスがトレーサビリティがあり、高品質な製品であることを保証し、米国FDAやEU EMAのルールに準拠していることを確認します。オーストラリアTGAや中国NMPAも満たされています。ヤオハイ・バイオファーマは、欧州連合の適格者(QP)による現地審査を成功裏に通過し、私たちのGMP品質システムと製造サイトを確保しました。また、ISO9001品質マネジメントシステムおよびISO14001環境マネジメントシステムの初期認証審査も通過しています。
Yaohai Bio-Pharmaは、GMP微生物細胞バンキングのトップ10プロデューサーであり、微生物発酵に特化しています。私たちは、最先端の設備と強固なRD製造能力を持つ現代的な施設を設立しました。GMP基準に準拠した微生物の精製および発酵用の5つの製剤生産ラインと、バイアルやカートリッジ、プリフィルドシリンジ用の2つの自動充填・仕上げラインが利用可能です。利用可能な発酵規模は100Lから2000Lです。バイアルの充填仕様は1ml~25mlをカバーし、プリフィルドカートリッジまたはシリンジの充填仕様は1~3mlです。生産工場はcGMP認証を取得しており、商業および臨床試験サンプルの供給が可能です。当社の工場では、世界中に輸出される大分子を生産しています。
Yaohai Bio-Pharmaは、微生物由来のバイオ医薬品におけるGMP適合の微生物細胞バンキングを提供しています。カスタムの研究開発および製造ソリューションを提供し、リスクを最小限に抑えます。再構成サブユニットワクチン、ペプチドホルモン、サイトカイン成長因子、単領域抗体、酵素、プラスミドDNA、mRNAその他の多くのモダリティに関与してきました。我々はいくつかの微生物ホストの専門家であり、例えば酵母(細胞外および細胞内、最大15グラム/リットル)や、バクテリアのペリプラズム分泌および可溶性細胞内包含体(最大10グラム/L)などです。さらに、BSL-2の微生物発酵プラットフォームを開発し、細菌ワクチンの開発を行っています。生産プロセスの改善により収量を増やし、コスト削減を実現してきた実績があります。効率的な技術チームによって、プロジェクトの迅速かつ信頼性の高い納期を保証し、製品を市場に早く投入します。