In base al dogma centrale, il messaggero RNA (mRNA) è il ponte per la trasmissione del materiale genetico dal DNA alle proteine.
il mRNA svolge un ruolo biologico codificando proteine in vivo, e l'mRNA maturo negli organismi eucariotici è composto da cinque componenti: 5' Cap (struttura del cap), 5' UTR (regione non codificante), ORF (frammento di lettura aperto), 3' UTR e coda polyA 3' (coda poliadenilata).
Dettagli dei Servizi
| Processo |
Servizio Opzionale |
Dettagli del servizio |
Periodo di Consegna (giorni) |
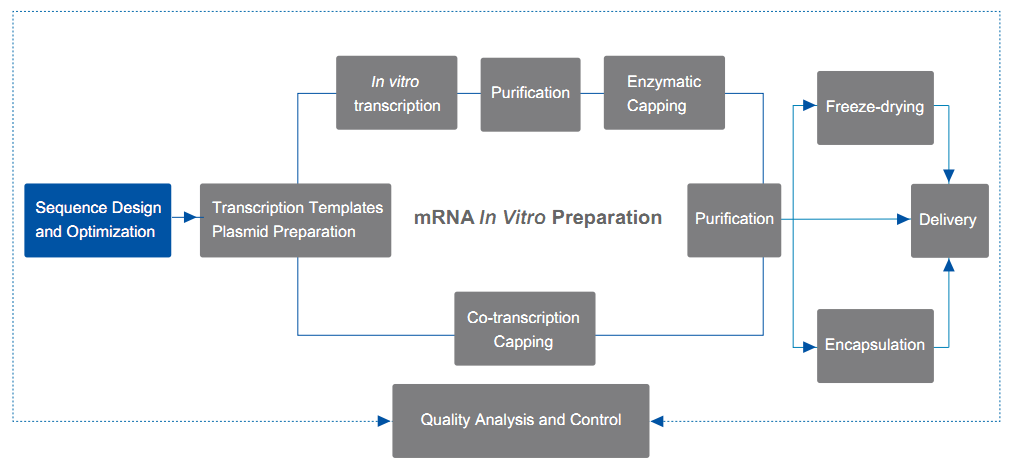
| progettazione e ottimizzazione della sequenza mRNA |
Progettazione e ottimizzazione delle sequenze codificanti |
Allineamento della sequenza CDS
Ottimizzazione del codone CDS
|
1 |
| Progettazione e ottimizzazione di sequenze non codificanti |
progettazione e ottimizzazione della sequenza del 5' UTR
progettazione e ottimizzazione della sequenza del 3' UTR
progettazione e ottimizzazione della sequenza polyA
|
1-2 |
Opzioni personalizzabili
| 5' UTR/3' UTR |
- Sequenza UTR naturale
- Sequenza UTR mutante/ingegnerizzata
|
| coda PolyA 3' |
- coda di 100A ~120A (consigliata)
- Coda polyA segmentata
- Altra coda personalizzata
|
Strategie comuni per la progettazione della sequenza di mRNA
| componenti mRNA |
Funzioni biologiche |
Strategie di ottimizzazione |
| cappuccio 5' |
Proteggere l'mRNA dalla degradazione da parte degli esonucleasi e agire in sinergia con la coda polyA alla fine 3', la proteina di legame polyA e il fattore di inizio traduzione per avviare la traduzione proteica. |
La struttura naturale Cap1 evita i recettori di riconoscimento dei pattern e quindi riduce la risposta immunitaria naturale, che può essere ottenuta tramite cappatura co-trascrizionale in un passaggio o cappatura enzimatica in due passaggi [vedi cappatura enzimatica mRNA e cappatura co-trascrizionale per dettagli]. |
| uTR 5' |
L'UTR 5' può essere riconosciuto dai ribosomi, regolare la traduzione dell'mRNA e influenzare la stabilità dell'mRNA. |
Contiene sequenze Kozak senza una struttura secondaria molto stabile. Gli UTR naturali di geni altamente espressi sono preferiti per la trascrizione in vitro (IVT) delle mRNA, come α-globina e β-globina. |
| CDS |
Regioni codificanti proteine e sequenze codificanti per antigeni, anticorpi o altre proteine funzionali. |
L'ottimizzazione del codone aumenta il livello di traduzione, notando che alcuni codoni non ottimali possono svolgere un ruolo nella piegatura della proteina. |
| 3' UTR |
Regolano la traduzione del mRNA e la sua stabilità. |
Gli UTR naturali di geni altamente espressi sono preferiti per i mRNA IVT, come α-globina e β-globina. |
| codale polyA 3' |
Regolano l'espressione della proteina e proteggono la struttura del cappuccio dalla degradazione. |
È richiesta una lunghezza adeguata (100-150 bp); la codifica della coda polyA sul plasmide modello di trascrizione garantisce una lunghezza più definita della coda polyA. |
Le nostre caratteristiche
- Selezione diversificata della fonte UTR
Fonti multiple di biblioteche UTR naturali e modificate altamente espressi; strategia di modifica UTR matura;
- Team di ottimizzazione CDS all'avanguardia
Collabora con un team di algoritmi AI professionale per completare l'ottimizzazione dei codoni.
- Distribuzione uniforme della coda polyA
Aggiungi sequenze polyA in base ai template DNA per controllare la lunghezza del mRNA in modo più preciso.
- Combinazioni di ottimizzazione variegate
Raggiungere un'espressione efficiente di mRNA con bassa immunogenicità.
Studio di caso
Progettazione di una mRNA a doppio reporter: mRNA mCherry-eGFP
Il servizio mRNA di Yaohai Bio-Pharma continua ad essere aggiornato con il progetto e l'ottimizzazione di una sequenza tandem di doppio gene reporter, che consente la co-espressione di due geni.
Utilizzando un reagente di trasfusione convenzionale, la mRNA mCherry-eGFP con sequenza tandem di doppio gene viene trasfusa in cellule 293T, e dopo 48 ore vengono rilevati due segnali fluorescenti di mCherry (rosso) e proteina fluorescente verde migliorata (eGFP) con espressione simultanea, e il grafico sovrapposto è evidenziato in giallo.

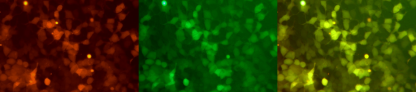
Espressione di mRNA mCherry-eGFP nelle cellule 293T

 IT
IT
 EN
EN AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 JA
JA
 KO
KO
 NO
NO
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN