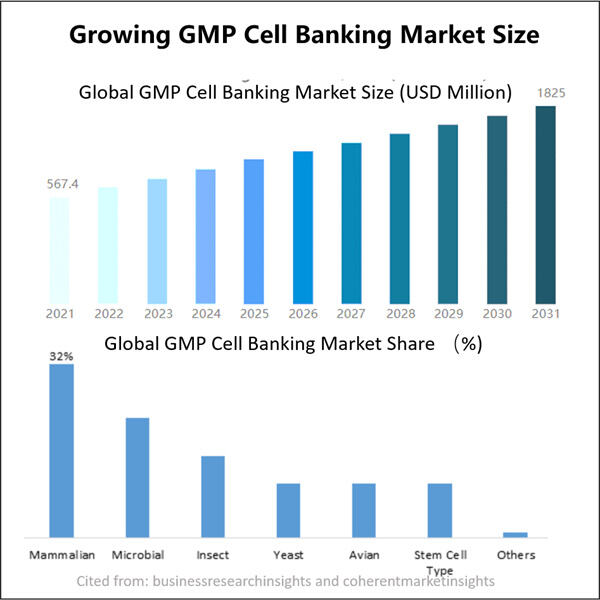
A GMP mikrobiológiai sejttárolás előnyei a biofarmaceutikai fejlesztés szempontjából
Mit nyerhetek a GMP Mikrobiológiai Sejttároló használatából az orvosszerek gyártásához? Ezzel hatékonyabban mentjük el egyes termelési időket, amely egyik kulcs előnye, mivel ellenőrizhető, hogy a sejtek több termelés során is konzisztensek. Ez azt jelenti, hogy a sejtminőség konzisztens lesz minden kötegben ugyanazon serlegen belül. Minőségbiztosítás - fontos annak érdekében, hogy a gyógyászat valójában biztonságosan elérje Önt. Ha készen áll egy sejttároló, az orvosszerek gyártói majdnem akkor is új köteget tudnak gyártani, amikor már kevés marad a korábbiakból. Ennek célja, hogy legyen jótékonyságos és rendszeres orvosszer-készlet.
A cég biztosítani kell egy szabadalmazott eljárást és fenntartania kell a sejteit egy GMP CMV Antigen Gyártás . Ezek a sejtek, amelyek gyógyszerek előállításához szükségesek, védeni kell a gingivitis és más szennyező anyagoktól. Ez azt jelenti, hogy a sejtek olyan tisztességes és steril környezetben növekednek. Ez azt is jelenti, hogy a környezetük tisztességes és bármilyen potenciális szennyező anyagtól mentes, ugye? A sejteket krioprezerválják szállításhoz és megtartáshoz nagyon alacsony hőmérsékleten. A sejtbanknak biztosítania kell, hogy a sejtek megőrzése közben semmi rossz (például bacterium vagy vírus, amelyek károsak) ne kerüljön belejük. Ilyen gondos kezelés azt jelenti, hogy a sejtek mindig tisztességesek és készek arra, hogy elinduljanak.

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NO
NO
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN