Độ Tuỳ Chỉnh, Hiệu Quả & Tiết Kiệm Chi Phí
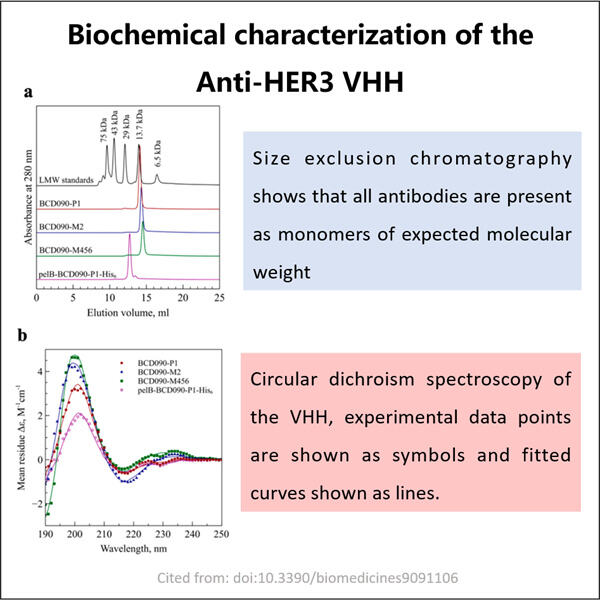
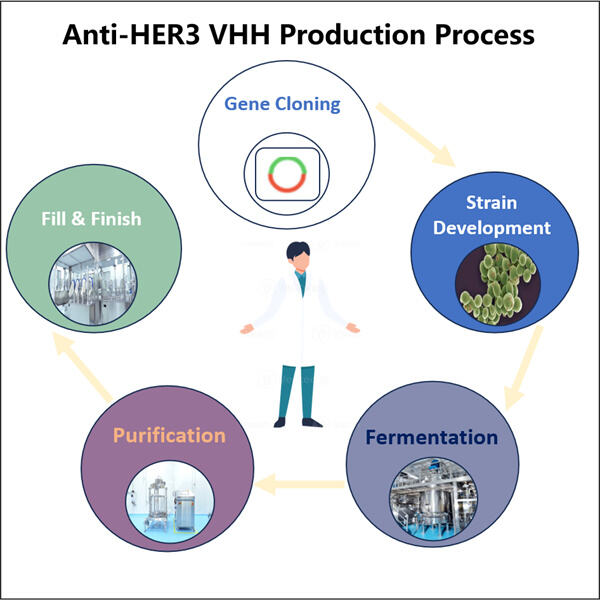
Yaohai Bio-Pharma có kinh nghiệm trong việc sản xuất sinh phẩm được tạo ra từ vi sinh vật. Chúng tôi cung cấp các giải pháp RD theo yêu cầu cũng như dịch vụ sản xuất trong khi tối thiểu hóa rủi ro. Chúng tôi đã làm việc với nhiều loại hình khác nhau như vắc-xin tiểu đơn vị tái tổ hợp, peptit, hormone, cytokine, yếu tố tăng trưởng, kháng thể đơn miền, enzym, plasmid DNA, mRNA và các loại khác. Chúng tôi chuyên về một số vi sinh vật như nấm men, tiết ra ngoài tế bào và bên trong tế bào (lượng thu lên đến 15g/L), vi khuẩn, tan trong dung dịch bên trong tế bào và khối bao gồm (lượng thu lên đến 10g/L). Chúng tôi cũng đã phát triển hệ thống lên men BSL-2 để tạo ra GMP Anti-HER3 VHH Sản xuất vắc-xin. Chúng tôi là chuyên gia trong việc tối ưu hóa quy trình sản xuất, tăng năng suất và giảm chi phí. Chúng tôi có một đội ngũ công nghệ hiệu quả cao đảm bảo giao dự án đúng thời hạn và chất lượng tốt nhất. Điều này cho phép chúng tôi đưa sản phẩm độc đáo của bạn nhanh hơn đến thị trường.

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NO
NO
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN