Значэнне разработкі формуляў
Біялогічныя лекарства, такія як рекамбінацыйныя белкі або пептыды, менш стаялыя, чым малыя молекулы. Калі лекарства не можа быць даставлена ў стаялай форме, тоно нават не пераходзіць у штадыя first-in-human (FIH).
Таму разработка формуляў з'яўляецца адной з найважнейшых частак у біялагічным жыццёвым цыкле для забеспечэння якасці, эфектыўнасці і стаяласці лекарства падчас вытвору, транспартавання, даўністай сховішча і адміністрацыі.
Ключавыя словы: разработка і аптымізацыя біяфармацеўтычных формуляў, форма дачы біялогічных лекарств, склад формуляцыі лекарства, прадформульныя навукі, даследванне формуляў, скрінінг формуляў
Прымененне: біяфармацевтычная праломніца, лікаўная спадчына для чалавека, лікаўная спадчына для жывёл, вакцыны, рекамбінантныя вялыя молекулярныя біялогічныя прадукты, біялогічныя прадукты, біялагічны рэagens
Службы разработкі формуляў yaohai Bio-Pharma
Жыдкі і ліофілізаваныя (замарожана сушка) формуляцыі ў тэперашні час прадстаўляюць найбуйнейшыя шляхі адміністрацыі біягалікаў.
Yaohai Bio-Pharma спецыялізуецца на розробцы жыдкага Вещасна (DS) ці Лекарственнага Вырабу (DP), а таксама ліофілізаванага DP у флаконах ці перадзаповных срынгах для розных шляхіў адміністрацыі, уключая інтравенную (IV), падкожную (SC), інтравітреальную (IVT) і інгаляцыйную (INH).
Мы выкарыстоўваем Мэтад адзінога чынніка (OTAF) ці Дызайн эксперыментаў (DoE) для фазавай дапасоўванай разработкі і аптымізацыі формуляцыі, уключаючы наступныя крокі:
- Працягнутая праўчная спаборніка ўласцівасцей белка і стаякасці
- Скринінг і аптымізацыя формуляцыі жыдкага Вещасна (DS)
- Скринінг і аптымізацыя формуляцыі жыдкага Лекарственнага Вырабу (DP)
- Скринінг і аптымізацыя формуляцыі ліофілізаванага Лекарственнага Вырабу (DP)
- Размяжэнне процесу запалення і цыклу ліофілізавання
- Стандартныя даследы стаякасці ў рэальным часе і праскарджаныя, а таксама акутныя стрэсавыя даследы
Дэталі сервісу
| Дэталі сервісу |
Аперацыі ў адзінку |
Наша фокус |
| Тэsts прадформулявання |
Фізіка-хімічныя ўласцівасці Тэsts стабільнасці |
Выбраць дапушчальную формуляванне (напрыклад, раствар, ліофілізаваны) для ранніх ці паўднёвых клінічных спроб |
| Раствар DS ці DP формуляванне |
Выsoскорастная скрінінг раствараў |
Кампаненты буфара, pH, Іонная сіла, стабілізатары, сарфактанты, экстыліенты, ад'юванты і інш. |
| Ліофілізаванае DP формуляванне |
Выsoскорастная скрінінг ліофілізаваных формуляванняў |
Ліофізаўтэльныя дадаткі (напрыклад, сацро́за, трэгалёз), буферная сістэма, дапаможнікі, і т.д. |
| Разработка працэсу для раствару ў жыдкім стане |
Падготовка ад'юванта і стерылізацыя - неабходна ў разе неабходнасці |
Даследаванне стаялісці фармалізацыі ад'юванта |
| Разбавленне DS і падготовка DP |
Доза, даследаванне насосавання, хуткаść мешання, сілы сягу |
| Залейка і заканчаючы этап |
Аб'ём заливкі, даследаванне мешання, сілы сягу |
| Разработка ліофізавальнага працэсу |
Разработка цыклу ліофізавання |
Якасць ліофізаванага DP |
| Праўядзенне тэсту якасці |
Чыстасць, цэлысць, салюбнасць, вісказімасць, актыўнасць і агрэгацыя і т.д. |
Уплыв складу і працэсаў формулявання на якасць DS/DP |
| Студыі стабільнасці |
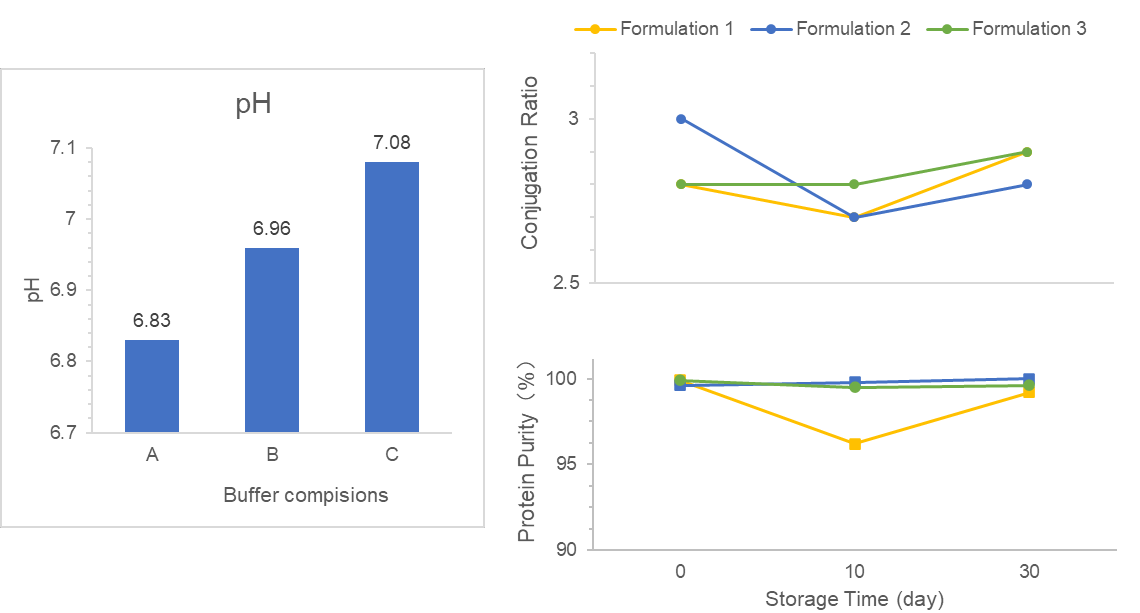
Прыклад даследвання
Нам замоўляюць скрыні DS/DP формулявання і дызайн працэсу DS/DP для vakcynы-кон’югата VLP.
Па-першай, мы выбрали падходящыя буферы ў складзе DS, якія адпавядаюць пажаданым кryтэрам стабільнасці, біядаступнасці і клінічнай безпаснасці. Па-другай, мы аптымізавалі некалькі чыннікаў ў формуляванні DP з adjuvant'ам, каб павялічыць узроўень абсорбцыі антыгена. Кропка прыкладна была ў якасці DS/DP і развіцці стабільнага працэсу вытвору.

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NO
NO
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN


