당신이 만드는 약을 테스트하는 것이 얼마나 중요한지 생각해 본 적이 있습니까? 모든 약은 매장에서 판매되거나 투여되기 전에 수천 번의 테스트를 거쳐야 합니다. 멸균 재조합 콜라겐 III 환자. 이것은 매우 중요합니다. 우리는 아무도 그들이 받는 약으로 인해 다치거나 병에 걸리지 않도록 해야 하기 때문입니다. 재조합 단백질 Lot Release Testing은 그들이 약을 만드는 데 하는 핵심 테스트 중 하나입니다. 이것은 우리가 사용하는 약이 확실한 품질과 안전성을 가지고 있는지 확인하기 위한 필수 절차입니다.
회사에서는 재조합 단백질 로트 릴리스 테스트를 사용하여 의약품이 대중에게 공개되기 전에 최상의 상태인지 확인합니다. 일부 특수 유형과 매우 복잡한 의약품은 정교한 기술을 통해 제조됩니다. 이러한 의약품은 많은 경우 특수한 미생물 생물학 모달리티 다양한 질병을 치료하는 것이 목적인 단백질. 약물이 인간에게 안전하지 않게 만드는 나쁜 일을 하는 데 대한 문제점을 찾는 매우 신중하게 통제되고 엄격한 방법. 약물이 충분한 테스트 없이 시장에 출시되면 심각한 건강 피해를 입힐 가능성이 있습니다.

이 테스트는 치료의 단백질의 다양한 특성을 보여줍니다. 테스트는 다음 사항만 검사합니다. 리포터 circRNA 단백질이 순수하든 순수하지 않든, 그 용액에는 독성 물질이 포함되어서는 안 됩니다. 마치 식사를 살펴보며 나쁜 부분이 있는지 확인하는 것과 같습니다. 또한 이 검사는 단백질이 질병을 치료하고 실제로 사람들이 더 나은 기분을 느낄 수 있도록 제대로 작용하는지 모니터링합니다. 또한 이 검사는 누군가가 아플 수 있는 세균이나 바이러스가 없는지 확인합니다. 우리 모두는 약물이 생명을 구하는 데 필요하다는 것을 알고 있으며, 우리가 복용하는 약물에는 해를 끼칠 물질이 없어야 한다는 것이 정말 중요합니다.
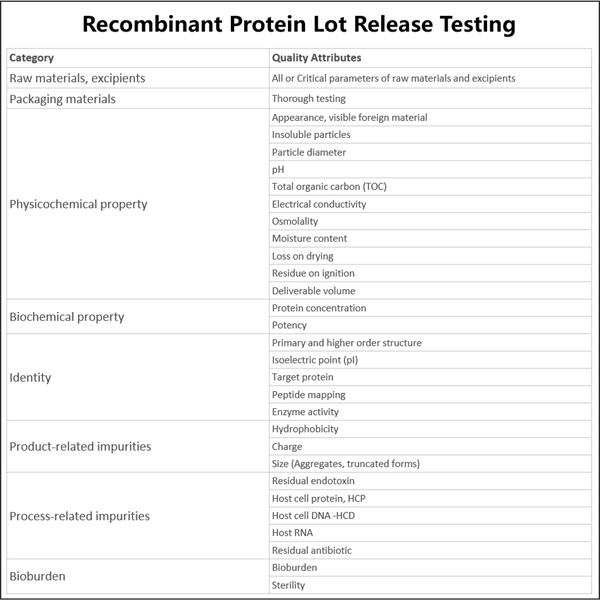
재조합 단백질 로트 릴리스 테스트에서는 다양한 개별 테스트를 사용하여 의약품이 안전하고 효과적인지 확인합니다. 그 중 두 가지는 HPLC(고성능 액체 크로마토그래피)와 SDS-PAGE(도데실황산나트륨 폴리아크릴아미드 겔 전기영동)입니다. 이 모든 것이 기술적이고 과학적으로 들리지만 실제로는 의약품의 단백질 품질을 확인하는 데 사용되는 다양한 방법일 뿐입니다. 게다가 검색 경로는 내독소 테스트 및 미생물 테스트를 포함한 다른 테스트로도 수행됩니다. 테스트를 통해 회사는 의약품에 문제가 없는지 확인하고 환자에게 최상의 제품만 보냅니다.
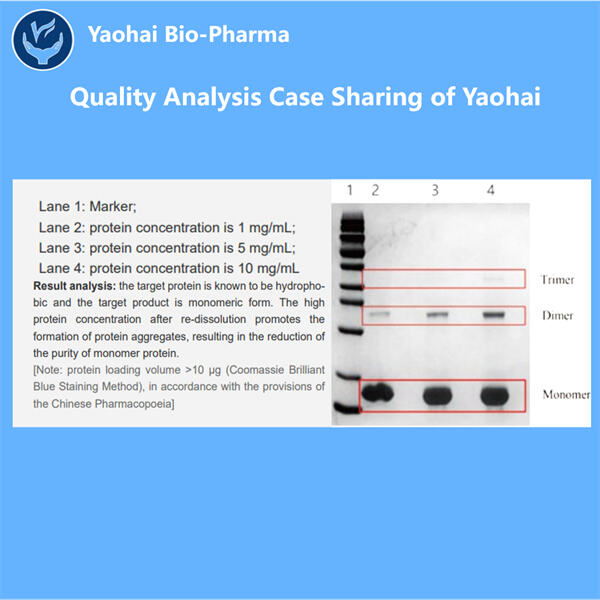
인간이 복용하는 약의 효과는 인간의 삶에 큰 영향을 미치며, 이를 통해 안전성을 보장하지 않으면 사람들에게 약을 전달할 수 없으므로 재조합 단백질 로트 방출 시험은 중요한 절차입니다. 이는 회사에서 약물이 강력하고 순수하며 그대로 유지되는지 확인할 수 있도록 하는 데 중요합니다. 이를 통해 환자는 적절한 용량의 약을 복용하고 있으며 자신에게도 안전하다는 사실을 확신할 수 있습니다. 이 시험은 또한 오염으로 이어지고 결국 사람을 아프게 하는 것 외에 해로운 것을 식별합니다. 그리고 이 시험은 종종 해로운 약이 판매되는 것을 막았고, 사람들을 보호하고 심지어 생명을 구했습니다. 이는 환자가 최상의 치료를 받고 최소한의 해를 입도록 하는 절차의 필수적인 단계입니다.
Yaohai Bio-Pharma는 미생물에서 생성된 생물학적 제제 제조에 대한 경험이 있습니다. 우리는 위험을 최소화하면서 맞춤형 RD 솔루션과 제조 서비스를 제공합니다. 우리는 재조합 서브유닛 백신, 펩타이드, 호르몬, 사이토카인, 성장 인자, 단일 도메인 항체, 효소, 플라스미드, DNA, mRNA 및 기타와 같은 다양한 방식으로 작업했습니다. 우리는 효모, 세포 외 및 세포 내 분비(수율 최대 15g/L), 박테리아, 세포 내 가용성 및 포함체(수율 최대 10g/L)와 같은 여러 미생물을 전문으로 했습니다. 우리는 또한 재조합 단백질 Lot Release Testing 백신을 만들기 위해 BSL-2 발효 시스템을 만들었습니다. 우리는 생산 공정을 최적화하고 수율을 높이고 비용을 줄이는 전문가입니다. 우리는 시기적절하고 최고 품질의 프로젝트 제공을 보장하는 고효율 기술 팀을 보유하고 있습니다. 이를 통해 고유한 제품을 시장에 더 빠르게 제공할 수 있습니다.
Yaohai Bio-Pharma는 재조합 단백질 Lot Release Testing을 전문으로 하는 상위 10대 생물학 회사입니다. 당사는 강력한 RD 역량과 현대적인 제조 시설을 갖춘 현대적인 제조 시설을 구축했습니다. 미생물 발효 및 정제를 위한 GMP 표준을 준수하는 100개의 약물 물질 생산 라인과 바이알 및 카트리지를 위한 2000개의 충전 및 최종 라인, 사전 충전 바늘을 쉽게 이용할 수 있습니다. 사용 가능한 발효 규모는 1L에서 25L 사이입니다. 충전 용량은 3ml에서 3.5ml까지입니다. 사전 충전된 주사기 또는 카트리지는 XNUMX~XNUMXml로 채워집니다. cGMP를 준수하는 당사의 생산 워크숍은 임상 샘플과 상업용 제품의 지속적인 공급을 보장합니다. 당사 시설은 전 세계로 수출되는 대형 분자를 생산합니다.
Yaohai Bio-Pharma는 선도적인 미생물 생물학 CDMO입니다. 당사는 인간, 수의학 및 애완동물 건강 관리를 위한 미생물 생산 치료제 및 백신에 집중해 왔습니다. 당사는 재조합 단백질 Lot Release Testing RD 플랫폼과 미생물 균주 세포, 방법 및 프로세스의 개발부터 상업적 및 임상적 제조에 이르기까지 전체 프로세스를 포괄하는 제조 기술을 갖추고 있어 최첨단 솔루션의 성공적인 구현을 보장합니다. 당사는 미생물 세포의 생물학적 처리에 대한 방대한 경험을 쌓았습니다. 당사는 200개가 넘는 글로벌 프로젝트를 수행했으며, 고객이 미국 FDA, EU EMA, 호주 TGA 및 중국 NMPA의 법률을 탐색하도록 돕습니다. 당사의 전문 지식과 광범위한 경험을 통해 시장 수요에 신속하게 대응하고 맞춤형 CDMO 서비스를 제공할 수 있습니다.
Yaohai BioPharma는 품질 관리와 규제 업무를 통합한 상위 10대 미생물 CDMO입니다. 당사의 품질 시스템은 현재 GMP 표준과 국제 규정을 준수합니다. 당사의 규제 전문가 팀은 생물학적 출시를 가속화하기 위한 글로벌 규제 프레임워크에 능숙합니다. 당사는 추적 가능한 생산 절차, 고품질 제품, 재조합 단백질 Lot Release Testing 및 EU EMA의 요구 사항을 준수합니다. 호주 TGA 및 중국 NMPA도 충족합니다. Yaohai BioPharma는 유럽 연합(QP)의 자격을 갖춘 사람이 실시한 대면 감사를 성공적으로 통과하여 GMP 시스템과 생산 시설을 검사했습니다. 또한 ISO9001 품질 관리 시스템 및 ISO14001 환경 관리 시스템의 초기 인증 감사를 완료했습니다.