Значення розробки формування
Біологічні ліки, такі як рекомбінантні білки або пептиди, менш стабільні, ніж малечастинкові ліки. Якщо лікарський засіб не можна доставити у стабільній формі, він навіть може не перейти до досліджень на людях (FIH).
Отже, розробка формування є одним із найважливіших аспектів у біологічному циклі життя для забезпечення якості, ефективності та стабільності ліків під час виробництва, перевезення, довготривалого зберігання та адміністрування.
Ключові слова: Розробка та оптимізація формування біофармацевтичних засобів, дозувальна форма біологічних препаратів, склад лікарського формування, передформальні дослідження, дослідження формування, екранування формувань
Застосування: біофармацевтична промисловість, людська медицина, ветеринарна медицина, вакцини, рекомбінальні великі молекулярні біологічні продукти, біологічні продукти, біологічні реактиви
Послуги з розробки формування компанії Yaohai Bio-Pharma
Жидкі та ліофілізовані (заморожені в сухому вигляді) форми на даний момент є найбільш поширеними шляхами адміністрування біологічних препаратів.
Yaohai Bio-Pharma спеціалізується на розробці рідинної речовини лікарського засобу (DS) або лікарського продукту (DP), а також ліофілізованого DP у флаконах або попередньо наповнених шприцях для різних шляхів адміністрування, включаючи інтравенозний (IV), підшкірний (SC), інтратрековий (IVT) та інгаляційний (INH).
Ми застосовуємо метод «Один раз — один фактор» (OTAF) або планування експериментів (DoE) для фазово відповідного розвитку та оптимізації формул, включаючи наступні кроки:
- Передформульна перевірка фізико-хімічних властивостей та стійкості білків
- Скрінінг та оптимізація формули рідинної речовини лікарського засобу (DS)
- Скрінінг та оптимізація формули рідинного лікарського продукту (DP)
- Скрінінг та оптимізація формули ліофілізованого лікарського продукту (DP)
- Розробка процесу заповнення та циклу ліофілізації
- Стандартні реальні та прискорені дослідження стійкості, а також острі стресові дослідження
Деталі послуги
| Деталі послуги |
Одиниці операцій |
Наше напрямку |
| Передформульовна тестування |
Фізико-хімічні властивості Тестування стійкості |
Визначте відповідну формування (наприклад, рідина, ліофілізована) для ранніх або пізніших клінічних досліджень |
| Рідка DS або DP формування |
Високопродуктивне екранування рідкої форми |
Склад буферів, pH, Іонна сила, стабілізатори, поверхнево-активні речовини, ексipients, ад'юванти тощо. |
| Ліофілізована форма DP |
Високопродуктивне екранування ліофілізованої форми |
Ліопротектор (наприклад, сухароза, трегалоза), буферна система, додаткові речовини тощо. |
| Розробка процесу для розчинної форми ДП |
Підготовка та стерилізація ад'юванту - опціонально |
Дослідження стійкості формуляції ад'юванту |
| Розбавлення ДС та підготовка ДП |
Доза, дослідження насосування, швидкість перемішування, збіжні сили |
| Заповнення та закінчення |
Об'єм заповнення, дослідження перемішування, збіжні сили |
| Розробка процесу ліофілізації |
Розробка циклу ліофілізації |
Якість ліофілізованої форми ДП |
| Випробування якості |
Чистота, цілісність, розчинність, в'язкість, активність та агрегація тощо. |
Вплив складу та процесів формулювання на якість DS/DP |
| Дослідження стійкості |
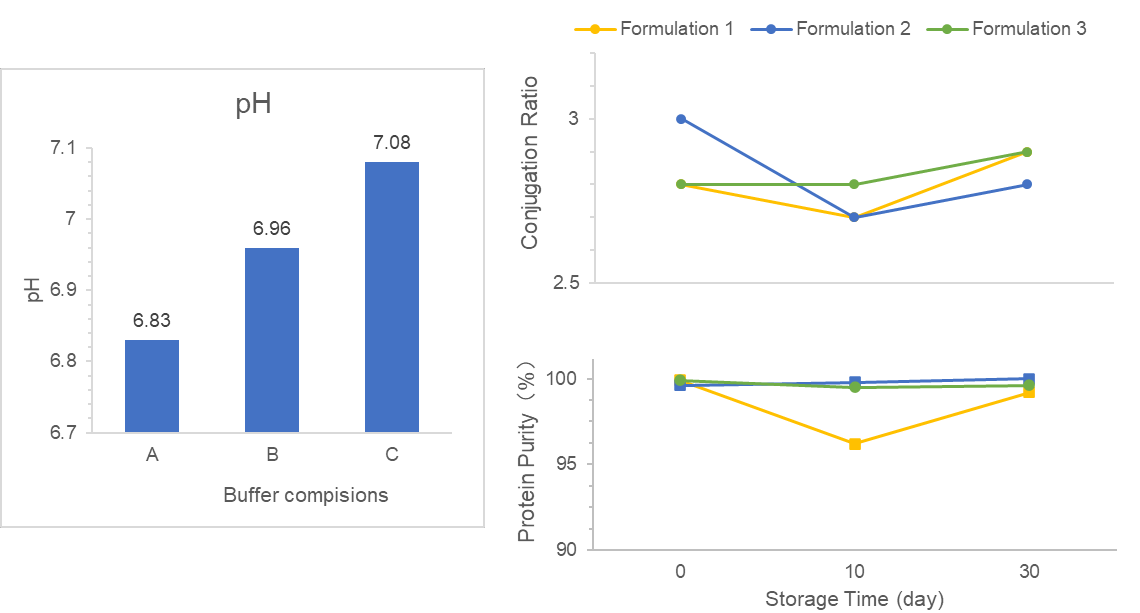
Вивчення випадку
Нам поручено провести екранування формулювання DS/DP та проектування процесу DS/DP для вакцини, конjugованої з VLP.
По-перше, ми екранували придатні буфери в формулі DS, щоб задовольняти бажані показники стабільності, біодоступності та клінічної безпеки. По-друге, ми оптимізували декілька факторів в формулі DP на основі ад'юванту для покращення рівнів абсорбції антигена. Крім того, ми зосередилися на якості DS/DP та розробили стабільний процес виробництва.

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NO
NO
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN


