Signifikansi Pengembangan Formulasi
Obat biologis, seperti protein rekombinan atau peptida, kurang stabil dibandingkan dengan obat berbasis molekul kecil. Jika suatu obat tidak dapat disampaikan dalam bentuk yang stabil, mungkin obat tersebut bahkan tidak akan melewati studi first-in-human (FIH).
Oleh karena itu, pengembangan formulasi adalah salah satu aspek paling krusial dalam siklus hidup biologis untuk memastikan kualitas, efisiensi, dan stabilitas obat selama manufaktur, transportasi, penyimpanan jangka panjang, dan administrasi.
Kata Kunci: Pengembangan dan optimasi formulasi biopharmasi, bentuk dosis biologis, komposisi formulasi obat, studi pra-formulasi, penelitian formulasi, skrining formulasi
Aplikasi: industri biopharmaceutical, obat manusia, obat hewan, vaksin, biologis rekombinan molekul besar, biologis, reagen biologi
Layanan Pengembangan Formulasi dari Yaohai Bio-Pharma
Rumusan cair dan liofilisat (pengeringan beku) saat ini mewakili jalur administrasi yang paling umum untuk biologis.
Yaohai Bio-Pharma memfokuskan diri pada pengembangan zat obat (Drug Substance/DS) cair atau Produk Obat (Drug Product/DP) liofilisat dalam botol kaca atau suntikan prapenuhan untuk berbagai jalur administrasi, termasuk intravena (IV), subkutan (SC), intravitreal (IVT), dan inhalasi (INH).
Kami menerapkan Metode Faktor-Satu-Kali (One-Time-A-Factor/OTAF) atau Desain-Eksperimen (Design-of-experiments/DoE) untuk pengembangan dan optimasi rumusan yang sesuai dengan fase, termasuk langkah-langkah berikut:
- Pengujian pra-rumusan sifat fisiko-kimia dan stabilitas protein
- Penyaringan dan optimasi rumusan Zat Obat Cair (Drug Substance/DS)
- Penyaringan dan optimasi rumusan Produk Obat Cair (Drug Product/DP)
- Penyaringan dan optimasi rumusan Produk Obat Liofilisat (Drug Product/DP)
- Pengembangan proses Penimbangan-Penyelesaian (Fill-Finish) dan siklus liofilisasi
- Studi stabilitas waktu nyata dan dipercepat standar, serta studi stres akut
Detail Layanan
| Detail Layanan |
Operasi Unit |
Fokus Kami |
| Pengujian Pre-formulasi |
Sifat fisikokimia Pengujian stabilitas |
Menentukan formulasi yang sesuai (misalnya, cair, liofilisasi) untuk uji klinis awal atau akhir |
| Formulasi DS atau DP cair |
Penyaringan formulasi cair berkecepatan tinggi |
Komposisi buffer, pH, Kekuatan ionik, stabilizer, surfaktan, eksipien, adjuvan, dll. |
| Formulasi DP liofilisasi |
Penyaringan formulasi liofilisasi berkecepatan tinggi |
Lypoprotektor (misalnya, sukrosa, trehalosa), sistem buffer, bahan tambahan, dll. |
| Pengembangan proses untuk DP cair |
Persiapan adjuvan dan teknik sterilisasi - opsional |
Studi stabilitas formulasi adjuvan |
| Pengenceran DS dan persiapan DP |
Kekuatan dosis, studi pompa, kecepatan pengadukan, gaya geser |
| Isi dan Penyelesaian |
Volume isi, studi pencampuran, gaya geser |
| Pengembangan proses liofilisasi |
Pengembangan siklus liofilisasi |
Kualitas DP liofilisasi |
| Pengujian Kualitas |
Kemurnian, integritas, kelarutan, viskositas, aktivitas, dan agregasi, dll. |
Pengaruh komposisi formulasi dan proses terhadap kualitas DS/DP |
| Studi Stabilitas |
Studi Kasus
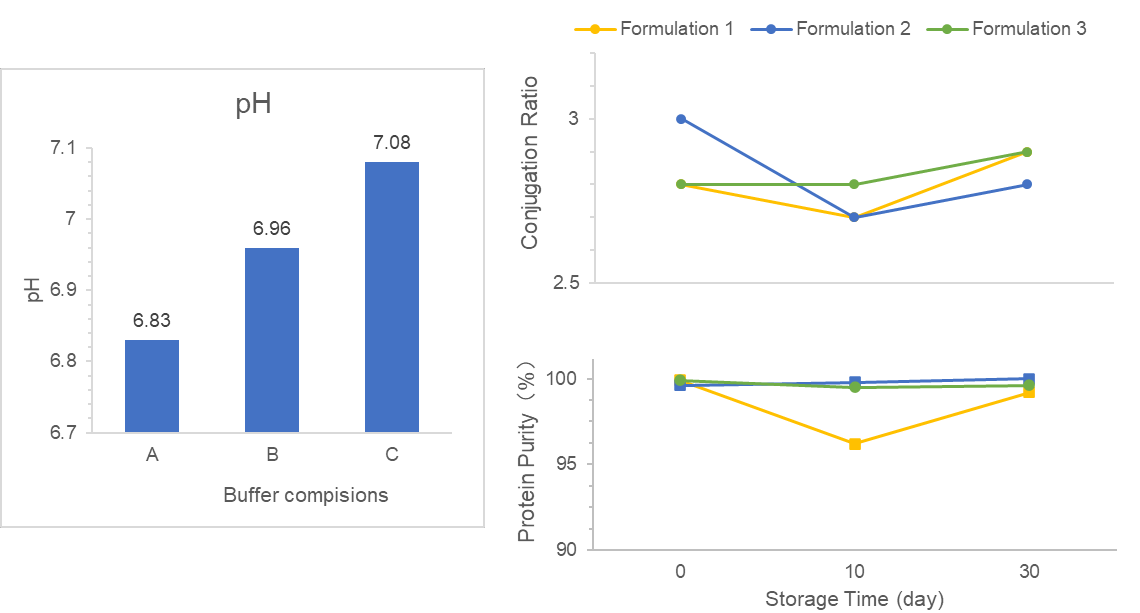
Kami diberi tugas untuk menyaring formulasi DS/DP dan merancang proses DS/DP untuk vaksin konjugat VLP.
Pertama, kami menyaring buffer yang sesuai dalam formulasi DS, memenuhi persyaratan stabilitas, bioavailabilitas, dan keamanan klinis yang diinginkan. Kedua, kami mengoptimalkan beberapa faktor dalam formulasi DP berbasis adjuvan untuk meningkatkan tingkat adsorpsi antigen. Selain itu, kami fokus pada kualitas DS/DP dan mengembangkan proses manufaktur yang stabil.

 EN
EN
 AR
AR
 HR
HR
 CS
CS
 DA
DA
 NL
NL
 FI
FI
 FR
FR
 DE
DE
 EL
EL
 IT
IT
 JA
JA
 KO
KO
 NO
NO
 PL
PL
 PT
PT
 RO
RO
 RU
RU
 ES
ES
 SV
SV
 IW
IW
 ID
ID
 LV
LV
 LT
LT
 SR
SR
 SK
SK
 SL
SL
 UK
UK
 VI
VI
 ET
ET
 HU
HU
 TH
TH
 TR
TR
 FA
FA
 AF
AF
 MS
MS
 BE
BE
 MK
MK
 UR
UR
 BN
BN


